De obicei reacțiile de electroliza apoasă și electroliză magmatică sunt efectuate cu electrozi de grafit și platină, care nu participă la reacție; ei conduc doar curent electric. Cu toate acestea, există unele cazuri specifice în care este necesar să se utilizeze electrozi activi, adică care suferă reducere și oxidare.
Principalele cazuri de utilizare a acestor electrozi care participă la procesul redox sunt: a purificare electrolitică a metalelor, cum ar fi zincul, cobaltul, nichelul și mai ales cuprul; și, de asemenea, galvanizare. Să vedem cum apare fiecare caz:
• Purificare electrolitică din cupru: această rafinare electrolitică a cuprului poate produce o puritate de aproximativ 99,9% și este utilizată în principal pentru fabricarea fire de cupru care, dacă au cea mai mică cantitate de impuritate, pot avea capacitatea lor de a conduce curent foarte electric diminuat.
Observați cum are loc acest proces, văzând schema unei cuve electrolitice asamblată mai jos:

O diferență de potențial se aplică soluției apoase de sulfat de cupru (CuSo
4 (aq)) - care conduce electricitatea - astfel încât anodul, care este un cupru metalic impur, pierde electroni, adică suferă oxidare, eliberându-și cationii (Cu2+), care se depun pe placa negativă. Aceasta ar putea fi o placă de platină inertă sau, mai bine, o placă de cupru pur. Constituie catodul, care se reduce pe măsură ce cuprul se depune în el. Astfel, semi-reacțiile care apar în electrozi sunt: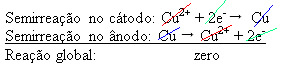
Faptul că a dat un rezultat zero indică faptul că nu a existat nicio reacție chimică, ci doar transportul cuprului. În partea de jos a recipientului se află celelalte substanțe impure care erau în cupru, cum ar fi aurul, argintul, silica (nisipul) și alte minerale, care pot fi chiar vândute.
• Galvanizare: un strat metalic se aplică unui material care urmează să fie protejat de coroziune.
Metalul ales pentru acoperire - care poate fi crom (crom), nichel (nichel), argint (argint), aur (aurire) sau zinc (galvanizare) - va fi anodul, electrod pozitiv, care suferă oxidare, pierzând electroni. Se supune oxidării în locul materialului protejat, deoarece potențialul său de reducere este mai mare.
Electrodul negativ, adică catodul, care primește acești electroni și suferă o reducere, este materialul însuși care a fost acoperit. În acest fel, rămâne protejat chiar dacă suprafața sa este cumva încălcată.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm
