Legătura ionică are loc între ioni, așa cum sugerează și numele său. Deoarece au sarcini opuse, cationii (element cu sarcină pozitivă) și anionii (element cu sarcină negativă) se atrag reciproc electrostatic, formând legătura. Cu toate acestea, un solid ionic este constituit dintr-un aglomerat de cationi și anioni organizat cu forme geometrice bine definite, numite rețele sau rețele cristaline.
De exemplu, sarea (clorură de sodiu) se formează prin transferul definitiv al unui electron din sodiu în clor, dând naștere cationului de sodiu (Na+) și anionul clorură (Cl-). În practică, această reacție implică nu doar doi atomi, ci un număr enorm și nedeterminat de atomi care formează o rețea cristalină în formă cubică, așa cum se arată mai jos:
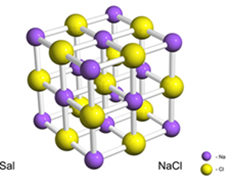
Dacă ne uităm la cristalele de sare cu un microscop electronic cu scanare, vom vedea că acestea sunt de fapt cubice datorită structurii lor interne.

Deoarece fiecare compus ionic este alcătuit dintr-un număr nedeterminat și foarte mare de ioni, cum putem reprezenta un compus ionic?
Formula utilizată de obicei este formula unitara, care este cel care reprezintă proporția exprimată prin cel mai mic număr posibil de cationi și anioni care alcătuiesc rețeaua cristalină, astfel încât sarcina totală a compusului să fie neutralizată. Pentru ca acest lucru să se întâmple, este necesar ca numărul de electroni renunțați de un atom să fie egal cu numărul de electroni primiți de celălalt atom.
Unele aspecte legate de formula unitară a compușilor ionici sunt importante, a se vedea unele:
- Scrieți întotdeauna cationul mai întâi și apoi anionul;
- Deoarece fiecare compus ionic este neutru din punct de vedere electric, sarcinile ionice individuale nu trebuie să fie notate;
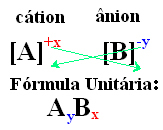
- Numerele de indice care apar pe partea dreaptă a fiecărui ion indică raportul dintre atomii cationului și anionul. Aceste numere se numesc indici, iar numărul 1 nu este scris.
De exemplu, în cazul clorurii de sodiu, avem ca formula sa unitară să fie NaCl, deoarece avem exact 1 cation de sodiu pentru fiecare anion clorură.
Vezi un alt exemplu, Al3+ are trei sarcini pozitive, în timp ce F- are un singur negativ, deci sunt necesari trei anioni fluor pentru a neutraliza compusul. Astfel, concluzionăm că formula sa unitară este AlF3.
O modalitate simplă de a ajunge la formula unitară a compusului ionic este schimbarea tarifelor sale pentru indicii săi, așa cum se arată într-un mod generic de mai jos:
Exemple:

O altă formulă utilizată pentru a reprezenta substanțe ionice este Formula Lewis sau formula electronică, ce reprezintă electronii din coaja de valență a ionilor „bile” din jurul simbolului elementului. În cazul sării, avem:

De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm
