Diferitele substanțe care există în univers sunt compuse din atomi, ioni sau molecule. Elementele chimice se combină prin legături chimice. Aceste legături pot fi:
| Legătură covalentă | legătură ionică | Conexiune metalică |
|---|---|---|
partajarea electronilor |
transfer de electroni |
Între atomii de metal |
Utilizați întrebările de mai jos pentru a vă testa cunoștințele despre legătura chimică.
Exerciții propuse
intrebarea 1
Pentru a interpreta proprietățile diferitelor substanțe, este necesar să cunoaștem legăturile dintre atomi și legăturile dintre moleculele respective. În legătură cu legătura dintre atomi se poate spune că ...
(A) între atomii legați predomină forțele de atracție.
(B) când se formează o legătură între atomi, sistemul format atinge energia maximă.
(C) atracțiile și repulsiile unei molecule nu sunt doar de natură electrostatică.
(D) între atomii legați există un echilibru între atracțiile electrostatice și repulsiile.
Alternativă corectă: (D) Între atomii legați există un echilibru între atracțiile electrostatice și repulsiile.
Atomii sunt formați de sarcini electrice și forțele electrice dintre particule conduc la formarea legăturilor. Prin urmare, toate legăturile chimice sunt de natură electrostatică.
Atomii au forțe de:
- repulsie între nuclei (sarcini pozitive);
- repulsie între electroni (sarcini negative);
- atracție între nuclei și electroni (sarcini pozitive și negative).
În toate sistemele chimice, atomii încearcă să devină mai stabili și această stabilitate se realizează într-o legătură chimică.
Stabilitatea se datorează echilibrului dintre forțele de atracție și respingere, deoarece atomii ating o stare de energie mai mică.
intrebarea 2
Potriviți corect frazele din coloana I și tipul de legătură din coloana II.
| Eu | II |
|---|---|
| (A) Între atomii de Na | 1. legătură covalentă simplă |
| (B) Între atomii de Cl | 2. legătură covalentă dublă |
| (C) Între atomii de O | 3. Conexiune metalică |
| (D) Între N atomi | 4. legătură ionică |
| (E) Între atomii de Na și Cl | 5. legătură covalentă triplă |
Răspuns:
Atomi |
Tipuri de conexiune |
Reprezentare |
(A) Între atomii de Na |
Conexiune metalică. Atomii acestui metal sunt legați între ei prin legături metalice și interacțiunea dintre sarcini pozitive și negative crește stabilitatea setului. |
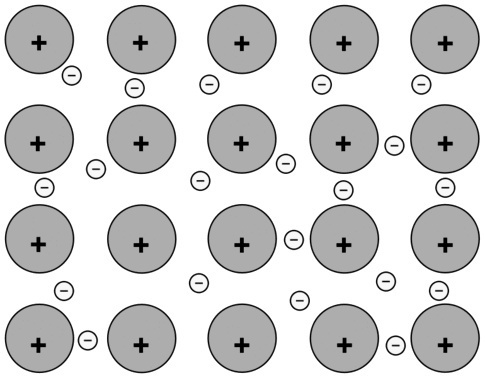 |
(B) Între atomii de Cl |
Legătură covalentă simplă. Partajarea electronilor și formarea unei legături simple apar deoarece există o singură pereche de electroni care leagă. |
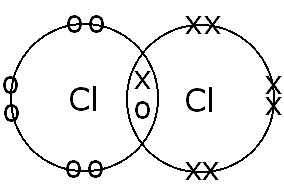 |
(C) Între atomii de O |
Dublă legătură covalentă. Există două perechi de electroni care leagă. |
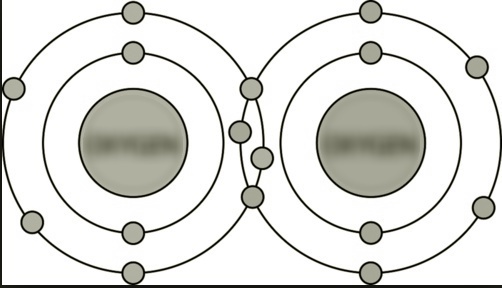 |
(D) Între N atomi |
Legătură covalentă triplă. Există trei perechi de electroni care leagă. |
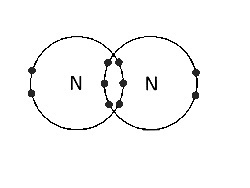 |
(E) Între atomii de Na și Cl |
Legătură ionică. Stabilit între ioni pozitivi (cationi) și ioni negativi (anioni) prin transfer de electroni. |
 |
întrebarea 3
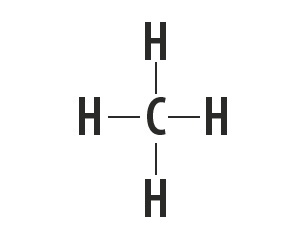
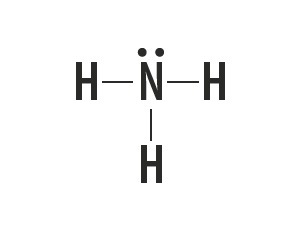
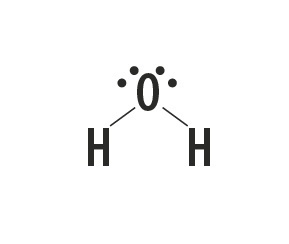
Metanul, amoniacul, apa și fluorura de hidrogen sunt substanțe moleculare ale căror structuri Lewis sunt reprezentate în tabelul următor.
| Metan, CH4 | Amoniac, NH3 | Apă, H2O | fluorură de hidrogen, HF |
|---|---|---|---|
 |
 |
 |
 |
Indică tipul de legătură stabilită între atomii care alcătuiesc aceste molecule.
Răspuns corect: Legătură covalentă simplă.
Privind tabelul periodic, vedem că elementele substanțelor nu sunt metale.
Tipul de legătură pe care aceste elemente îl formează între ele este legătura covalentă, deoarece împart electroni.
Atomii de carbon, azot, oxigen și fluor alcătuiesc opt electroni în carcasa de valență din cauza numărului de legături pe care le formează. Apoi respectă regula octetului.
Pe de altă parte, hidrogenul participă la formarea substanțelor moleculare prin împărtășirea unei perechi de electroni, stabilind legături covalente simple.
Vezi și tu: Legături chimice
întrebări la examenul de admitere
Întrebările despre legăturile chimice apar foarte mult la examenele de admitere la facultate. Vedeți mai jos cum poate fi abordat subiectul.
intrebarea 1
(UEMG) Proprietățile prezentate de un anumit material pot fi explicate prin tipul de legătură chimică prezentă între unitățile sale de formare. Într-o analiză de laborator, un chimist a identificat următoarele proprietăți pentru un anumit material:
- Temperatură ridicată de topire și fierbere
- Conductivitate electrică bună în soluție apoasă
- Conductor defect al electricității în stare solidă
Din proprietățile afișate de acest material, marcați alternativa care indică tipul predominant de conexiune din acesta:
(A) metalic
(B) covalent
(C) dipol indus
(D) ionic
Alternativă corectă: (D) ionică.
Un material solid are temperaturi ridicate de topire și fierbere, adică ar avea nevoie de multă energie pentru a se transforma într-o stare lichidă sau gazoasă.
În stare solidă, materialul este un conductor slab de electricitate din cauza organizării atomilor care formează o geometrie bine definită.
În contact cu apa, apar ioni, formând cationi și anioni, facilitând trecerea curentului electric.
Tipul de legătură care face ca materialul să aibă aceste proprietăți este legătura ionică.
intrebarea 2
(PUC-SP) Analizați proprietățile fizice din tabelul de mai jos:
| Probă | Punct de fuziune | Punct de fierbere | Conductivitate electrică la 25 ° C | Conductivitate electrică la 1000 ° C |
|---|---|---|---|---|
| THE | 801 ° C | 1413 ° C | izolator | conductor |
| B | 43 ° C | 182 ° C | izolator | |
| Ç | 1535 ° C | 2760 ° C | conductor | conductor |
| D | 1248 ° C | 2250 ° C | izolator | izolator |
Conform modelelor de legături chimice, A, B, C și D pot fi clasificate, respectiv, ca,
(A) compus ionic, metal, substanță moleculară, metal.
(B) metal, compus ionic, compus ionic, substanță moleculară.
(C) compus ionic, substanță moleculară, metal, metal.
(D) substanță moleculară, compus ionic, compus ionic, metal.
(E) compus ionic, substanță moleculară, metal, compus ionic.
Alternativă corectă: (E) compus ionic, substanță moleculară, metal, compus ionic.
Analizând stările fizice ale probelor atunci când acestea sunt supuse temperaturilor prezentate, trebuie să:
| Probă | Stare fizică la 25 ° C | Stare fizică la 1000 ° C | Clasificarea compușilor |
| THE | solid | lichid | ionic |
| B | solid | Molecular | |
| Ç | solid | solid | Metal |
| D | solid | solid | ionic |
Ambii compuși A și D sunt izolatori în stare solidă (la 25 ° C), dar când proba A se transformă în stare lichidă, aceasta devine conductivă. Acestea sunt caracteristicile compușilor ionici.
Compușii ionici în stare solidă nu permit conductivitatea din cauza modului în care atomii se aranjează.
În soluție, compușii ionici se transformă în ioni și permit conducerea electricității.
Este caracteristic metalelor conductivitatea lor bună ca probă C.
Compușii moleculari sunt neutri electric, adică izolatori precum proba B.
Vezi și tu: Conexiuni metalice
întrebarea 3
(Fuvest) Luați în considerare elementul compuși care formează clor, respectiv cu hidrogen, carbon, sodiu și calciu. Cu care dintre aceste elemente clorul formează compuși covalenți?
Răspuns:
| Elemente | Cum apare apelul | legătură formată | |
| clor | Hidrogen | 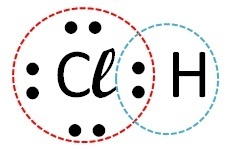 |
Covalent (partajarea electronilor) |
| clor | Carbon | 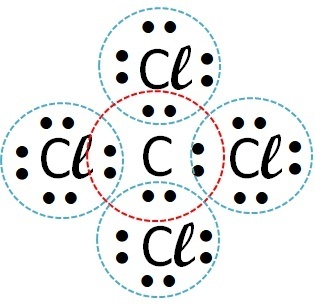 |
Covalent (partajarea electronilor) |
| clor | Sodiu |  |
Ionic (transfer de electroni) |
| clor | Calciu | 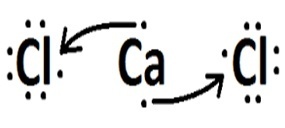 |
Ionic (transfer de electroni) |
Compușii covalenți apar în interacțiunea atomilor nemetalici, nemetalelor cu hidrogenul sau între doi atomi de hidrogen.
Deci legătura covalentă are loc cu clor + hidrogen și clor + carbon.
Sodiul și calciul sunt metale și se leagă de clor printr-o legătură ionică.
Întrebări despre Enem
Abordarea lui Enem asupra subiectului poate fi puțin diferită de ceea ce am văzut până acum. Vedeți cum au apărut legăturile chimice în testul din 2018 și aflați mai multe despre acest conținut.
intrebarea 1
(Enem / 2018) Cercetările arată că nanodispozitivele bazate pe mișcări atomico-dimensionale, induse de ușoare, pot avea aplicații în tehnologiile viitoare, înlocuind micromotoarele, fără a fi nevoie de componente mecanica. Un exemplu de mișcare moleculară indusă de lumină poate fi văzut prin îndoirea unei plăci subțiri de siliciu, legat de un polimer azobenzenic și un material suport, în două lungimi de undă, așa cum este ilustrat în figura. Odată cu aplicarea luminii, apar reacții reversibile ale lanțului polimeric, care promovează mișcarea observată.
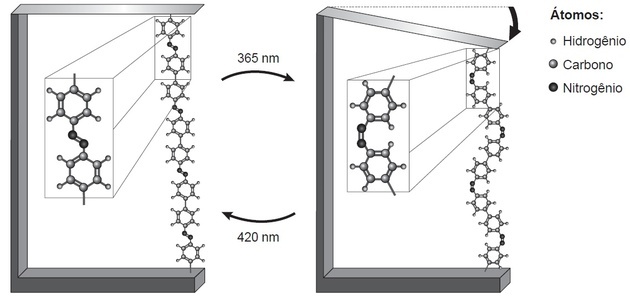
LUAȚI, H. ȘI. Nanotehnologia moleculelor. Noua chimie la școală, n. 21, mai 2005 (adaptat).
Fenomenul mișcării moleculare, promovat de incidența luminii, apare din (a)
(A) mișcarea vibrațională a atomilor, ceea ce duce la scurtarea și relaxarea legăturilor.
(B) izomerizarea legăturilor N = N, forma cis a polimerului fiind mai compactă decât trans.
(C) tautomerizarea unităților monomerice ale polimerului, ceea ce duce la un compus mai compact.
(D) rezonanță între electronii π ai grupului azo și cei ai inelului aromatic care scurtează legăturile duble.
(E) variația conformațională a legăturilor N = N care are ca rezultat structuri cu suprafețe diferite.
Alternativă corectă: izomerizarea (B) a legăturilor N = N, forma cis a polimerului fiind mai compactă decât trans.
Mișcarea în lanțul polimeric face ca un polimer mai lung să fie observat în stânga și unul mai scurt în dreapta.
Cu partea de polimer evidențiată, observăm două lucruri:
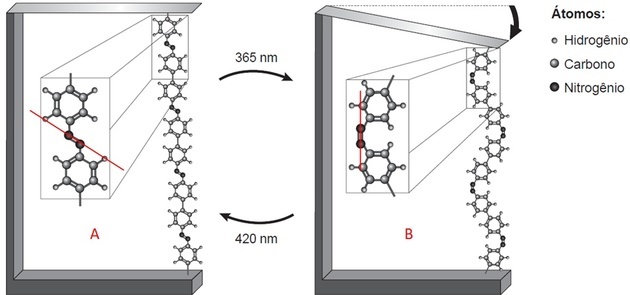
- Există două structuri care sunt legate printr-o legătură între doi atomi (ceea ce legenda indică este azot);
- Acest link este în poziții diferite în fiecare imagine.
Trăgând o linie pe imagine, în A observăm că structurile sunt deasupra și sub axa, adică laturile opuse. În B, ele se află pe aceeași parte a liniei trasate.
Azotul face ca trei legături să fie stabile. Dacă este atașat la structură printr-o legătură, atunci se leagă de celălalt azot printr-o legătură dublă covalentă.
Compactarea polimerului și îndoirea lamei au loc deoarece liantele se află în poziții diferite atunci când apare izomerismul legăturilor N = N.
Izomerismul trans este observat în A (linkeri pe laturile opuse) și cis în B (linkeri pe același plan).
intrebarea 2
(Enem / 2018) Unele materiale solide sunt compuse din atomi care interacționează între ei formând legături care pot fi covalente, ionice sau metalice. Figura arată energia potențială de legare în funcție de distanța interatomică într-un solid cristalin. Analizând această figură, se observă că, la temperatura de zero kelvin, distanța de echilibru a legăturii dintre atomi (R0) corespunde valorii minime a energiei potențiale. Peste această temperatură, energia termică furnizată atomilor le crește energia și cauzele cinetice oscilează în jurul unei poziții medii de echilibru (cercuri umplute), care este diferită pentru fiecare temperatura. Distanța de conectare poate varia pe întreaga lungime a liniilor orizontale, identificată cu valoarea temperaturii T1 T4 (creșterea temperaturilor).

Deplasarea observată la distanța medie relevă fenomenul de
(A) ionizare.
(B) dilatare.
(C) disociere.
(D) ruperea legăturilor covalente.
(E) formarea legăturilor metalice.
Alternativă corectă: (B) dilatare.
Atomii au sarcini pozitive și negative. Legăturile se formează atunci când ating o energie minimă prin echilibrarea forțelor (repulsie și atracție) între atomi.
Din aceasta înțelegem că: pentru a se produce o legătură chimică există o distanță ideală între atomi, astfel încât acestea să fie stabile.
Graficul prezentat ne arată că:
- Distanța dintre doi atomi (interatomici) scade până la atingerea unei energii minime.
- Energia poate crește atunci când atomii se apropie atât de mult încât sarcinile pozitive din nucleele lor se apropie, încep să se respingă reciproc și, prin urmare, cresc energia.
- La temperatura T0 de zero Kelvin este valoarea minimă a energiei potențiale.
- Există o creștere a temperaturii T1 la T4 iar energia furnizată determină oscilarea atomilor în jurul poziției de echilibru (cercuri umplute).
- Oscilația are loc între curbă și cercul complet corespunzător fiecărei temperaturi.
Pe măsură ce temperatura măsoară gradul de agitație al moleculelor, cu cât temperatura este mai mare, cu atât atomul oscilează mai mult și crește spațiul ocupat de acesta.
Cea mai ridicată temperatură (T4) indică faptul că va exista un spațiu mai mare ocupat de acel grup de atomi și astfel, materialul se extinde.
întrebarea 3
(Enem / 2019) Deoarece au un strat complet de valență, energie de ionizare ridicată și afinitate electronică practic nul, s-a considerat mult timp că gazele nobile nu ar forma compuși produse chimice. Cu toate acestea, în 1962, reacția dintre xenon (5s²5p⁶ strat de valență) și hexafluorură de platină a fost efectuată cu succes și, de atunci, au fost sintetizați mai mulți compuși noi de gaze nobile.
Astfel de compuși demonstrează că nu se poate accepta fără critică regula octetului, în care se consideră că, într-o legătură chimică, atomii tind să dobândească stabilitate presupunând configurația electronică a gazului nobil. Dintre compușii cunoscuți, unul dintre cei mai stabili este difluorura de xenon, în care doi atomi de halogen fluor (stratul de valență 2s²2p⁵) se leagă covalent la atomul de gaz nobil pentru a avea opt electroni de valenţă.
Când scrieți formula Lewis pentru compusul xenon menționat mai sus, câți electroni există în învelișul de valență al atomului de gaz nobil?
(A) 6
(B) 8
(C) 10
(D) 12
Alternativă corectă: c) 10.
Fluorul este un element care face parte din grupa 17 din Tabelul periodic. Prin urmare, în învelișul său electronic cel mai exterior există 7 electroni (2s2 2p5). Pentru a dobândi stabilitate, conform regulii octetului, atomul acestui element are nevoie de un electron pentru a avea astfel 8 electroni în învelișul de valență și să-și asume configurația electronică a unui gaz nobil.
Xenonul, pe de altă parte, este un gaz nobil și, prin urmare, are deja 8 electroni în ultimul strat (5s2 5p6).
Rețineți că numele compusului este difluorură de xenon, adică compusul este alcătuit din doi atomi de fluor și un atom de xenon, XeF2.
După cum se spune în declarație, legătura chimică dintre atomi este de tip covalent, adică există împărțirea electronilor.
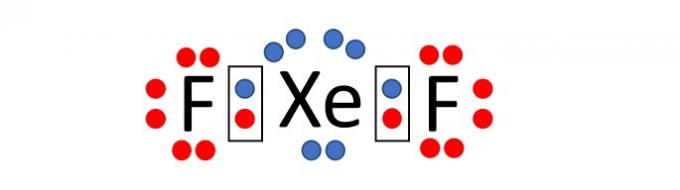
Distribuind electronii în jurul fiecărui atom (7 în jurul fluorului și 8 în jurul xenonului) vedem că atomul de xenon, atunci când se leagă cu doi atomi de fluor, are 10 electroni în învelișul de fluor. valenţă.
Vezi și tu:
- regula octetului
- Exerciții de distribuție electronică
- Exerciții pe hidrocarburi

