Echilibrul chimic este unul dintre subiectele care se încadrează cel mai mult în examenele de admitere și de admitere.
Aspectele reacțiilor reversibile sunt abordate în întrebări, iar candidații sunt evaluați atât prin calcule, cât și prin conceptele care implică această temă.
Având în vedere acest lucru, am făcut această listă de întrebări cu abordări diferite ale echilibrului chimic.
Profitați de comentariile rezoluției pentru a vă pregăti pentru examene și consultați instrucțiunile pas cu pas despre cum să rezolvați întrebările.
Concepte generale de echilibru chimic
1. (Uema) În ecuație , după atingerea echilibrului chimic, putem concluziona constanta de echilibru
, despre care este corect să afirmăm că:
a) cu cât valoarea lui Kc este mai mare, cu atât randamentul reacției directe este mai mic.
b) Kç indiferent de temperatura.
c) dacă viteza reacțiilor înainte și inversă este egală, atunci Kc = 0.
d) Kç depinde de molaritățile inițiale ale reactanților.
e) cu cât valoarea Kc este mai mare, cu atât este mai mare concentrația produselor.
Răspuns corect: e) cu cât valoarea Kc este mai mare, cu atât concentrația produselor este mai mare.
Reacția directă este reprezentată de numărul 1, unde:
Reacția inversă este reprezentată de
Valoarea lui Kç se calculează prin raportul dintre concentrațiile de produse și reactivi.
Numeratorul (care conține produsele) este direct proporțional cu constanta de echilibru. Prin urmare, cu cât valoarea lui K este mai mareç, cu cât randamentul reacției directe este mai mare, cu cât se formează mai mult produs și, în consecință, cu atât este mai mare concentrația produselor.
Valoarea lui Kç variază în funcție de temperatură, deoarece atunci când îi schimbăm valoarea, reacția endotermică (absorbție de căldură) sau exotermă (eliberare de căldură) poate fi favorizat și, cu aceasta, mai mult reactiv sau produs poate fi consumat sau creat, schimbând astfel constanta de echilibru care depinde de concentrația de reactivi.
Kc depinde de cantitățile molare ale componentelor atunci când se stabilește echilibrul și când ratele reacțiilor înainte și invers sunt egale.
2. (UFRN) Echilibrul chimic se caracterizează prin faptul că este dinamic la nivel microscopic. Pentru a obține informații cantitative despre întinderea echilibrului chimic, se utilizează cantitatea constantă de echilibru. Luați în considerare următoarea bandă:

Aplicat echilibrului chimic, ideea echilibrului personajului:
a) Este corect deoarece, în echilibru chimic, jumătate din cantități sunt întotdeauna produse, iar cealaltă jumătate sunt reactanți.
b) Nu este corect, deoarece, în echilibru chimic, concentrațiile produselor și ale reactanților pot fi diferite, dar sunt constante.
c) Este corect deoarece, în echilibru chimic, concentrațiile de reactanți și produse sunt întotdeauna aceleași, atâta timp cât echilibrul nu este deranjat de un efect extern.
d) Nu este corect, deoarece, în echilibru chimic, concentrațiile produselor sunt întotdeauna mai mari decât cele ale reactanților, atâta timp cât echilibrul nu este afectat de un factor extern.
e) Este corect deoarece, în echilibru chimic, concentrațiile de reactanți și produse nu sunt întotdeauna aceleași.
Răspuns corect: b) Nu este corect, deoarece, în echilibru chimic, concentrațiile de produse și cele ale reactanților pot fi diferite, dar sunt constante.
La echilibru, cantitățile de produse și reactivi pot fi calculate pe baza constantei de echilibru și nu neapărat ar trebui să fie jumătate din cantitatea de produse și cealaltă jumătate reactivi.
Concentrațiile de echilibru nu sunt întotdeauna aceleași, pot fi diferite, dar constante dacă nu apar perturbări în echilibru.
Concentrațiile de echilibru trebuie să depindă de reacția favorizată, directă sau inversă. Putem cunoaște acest lucru după valoarea lui Kç: dacă Kç 1, este favorizată reacția directă. deja dacă Kç
1 este favorizată reacția inversă.
Diagramele echilibrului chimic
3. (UFPE) La începutul secolului al XX-lea, așteptările primului război mondial au generat o mare nevoie de compuși de azot. Haber a început să producă amoniac din azot în aer. Dacă amoniacul este plasat într-un recipient închis, acesta se descompune conform următoarei ecuații chimice dezechilibrate: NH3(g) → N2 (g) + H2 (g). Variațiile concentrațiilor în timp sunt ilustrate în următoarea figură:

Din analiza figurii de mai sus, putem afirma că curbele A, B și C reprezintă variația temporală a concentrațiilor următoarelor componente ale reacției, respectiv:
a) H2, Nu2 și NH3
b) NH3, H2 si nu2
c) NH3, Nu2 si H2
d) Nu2, H2 și NH3
e) H2, NH3 si nu2
Răspuns corect: d) N2, H2 și NH3.
Pasul 1: echilibrați ecuația chimică.
2 NH3(g) → N2 (g) + 3 H2 (g)
Cu reacția echilibrată, ne-am dat seama că este nevoie de 2 moli de amoniac pentru a se descompune în azot și hidrogen. De asemenea, cantitatea de hidrogen produsă în reacție este de trei ori mai mare decât cea de amoniac.
Al doilea pas: interpretați datele graficului.
Dacă amoniacul este descompus, atunci în grafic concentrația sa este maximă și scade, așa cum se vede în curba C.
Produsele, pe măsură ce se formează, la începutul reacției, concentrațiile sunt nule și cresc pe măsură ce reactantul devine un produs.
Deoarece cantitatea de hidrogen produsă este de trei ori mai mare decât cea a azotului, atunci curba pentru acest gaz este cea mai mare, așa cum sa menționat în B.
Celălalt produs care se formează este azotul, așa cum se vede în curba A.
4. (Cesgranrio) Sistemul reprezentat de ecuație era în echilibru. Starea de echilibru a fost brusc modificată prin adăugarea substanței G. Sistemul reacționează pentru a restabili echilibrul. Care dintre următoarele diagrame reprezintă cel mai bine modificările care au avut loc în timpul procesului descris?
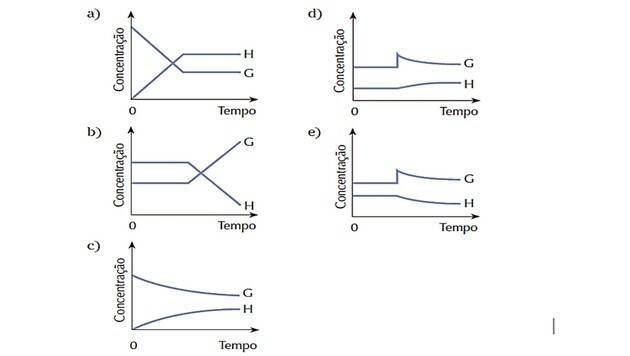
Răspuns corect: d).

Deoarece sistemul era în echilibru la început, cantitățile de substanțe G și H au rămas constante.
Perturbarea a apărut pe măsură ce concentrația de G a crescut și sistemul a reacționat transformând aceasta reactant în mai multe produse H, deplasând echilibrul spre dreapta, adică favorizând reacția direct.
Observăm că curba reactivului G scade pe măsură ce este consumată, iar curba produsului H crește pe măsură ce se formează.
Când se stabilește un nou echilibru, cantitățile devin constante din nou.
Constanta de echilibru: relatia dintre concentrare si presiune
5. (UFRN) Știind că KP = Kç (RT)n, putem spune că KP = Kç, pentru:
oţel2(g) + H2 (g) ↔ CO(g) + H2O(g)
b) H2 (g) + ½2 (g) ↔ H2O(1)
c) Nu2 (g) + 3 H2 (g) ↔ 2 NH3(g)
d) NU(g) + ½ O2(g) ↔ NU2(g)
e) 4 FeS(s) + 7 O2 (g) ↔ 2 Fe2O3 (e) + 4 SO2(g)
Răspuns corect: a) CO2(g) + H2 (g) ↔ CO(g) + H2O(g)
Pentru KP fii egal cu Kç variația numărului de aluniți trebuie să fie egală cu zero, deoarece orice număr crescut la zero are ca rezultat 1:
KP = Kç (RT)0
KP = Kç x 1
KP = Kç
Modificarea numărului de alunițe se calculează prin:
∆n = Numărul de moli de produse - Numărul de moli de reactivi
La acest calcul, participă doar coeficienții substanțelor în stare gazoasă.
Aplicând fiecărei ecuații alternative, avem:
| oţel2(g) + H2 (g) ↔ CO(g) + H2O(g) | ∆n = [(1 + 1) - (1 + 1)] = 2 - 2 = 0 |
| b) H2 (g) + ½2 (g) ↔ H2O(1) | ∆n = [0 - (1 + 1/2)] = 0 - 3/2 = - 3/2 |
| c) Nu2 (g) + 3 H2 (g) ↔ 2 NH3 (g) | ∆n = [2 - (1 + 3)] = 2 - 4 = - 2 |
| d) NU(g) + ½2 (g) ↔ NU2 (g) | ∆n = [1 - (1 + 1/2)] = 1 - 3/2 = - 1/2 |
| e) 4 FeS(s) + 7 O2 (g) ↔ 2 Fe2O3 (e) + 4 SO2 (g) | ∆n = [(0 + 4) - (0 + 7)] = 4 - 7 = - 3 |
Cu aceste rezultate, putem observa că alternativa a cărei valoare corespunde rezultatului cerut este cea din prima ecuație.
6. (Adaptat la UEL) Pentru reacția reprezentată de constantele de echilibru Kç și KP sunt exprimate prin ecuațiile: (Date: p = presiune parțială)
Alternativă corectă:
Constanta de echilibru este calculată prin:
Compușii solizi, datorită concentrațiilor lor constante, nu participă la calculul Kç, prin urmare, constanta de echilibru pentru ecuația dată este:
Pentru constanta de echilibru, în termeni de presiune, numai gazele participă la calcul, deci:
Calculul constantei de echilibru
7. (Enem / 2015) Mai mulți acizi sunt folosiți în industriile care elimină efluenții lor în corpurile de apă, cum ar fi râurile și lacurile, care pot afecta echilibrul ecologic. Pentru a neutraliza aciditatea, sarea de carbonat de calciu poate fi adăugată la efluent, în cantități adecvate, deoarece produce bicarbonat, care neutralizează apa. Ecuațiile implicate în proces sunt prezentate:
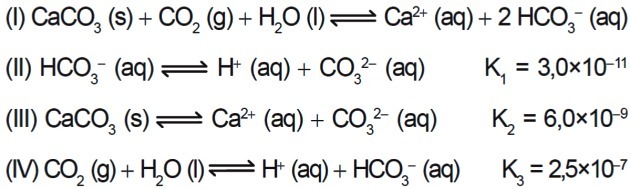
Pe baza valorilor constantelor de echilibru ale reacțiilor II, III și IV la 25 ° C, care este valoarea numerică a constantei de echilibru a reacției I?
a) 4,5 x 10-26
b) 5,0 x 10-5
c) 0,8 x 10-9
d) 0,2 x 105
e) 2,2 x 1026
Răspuns corect: b) 5,0 x 10-5
Primul pas: folosiți legea lui Hess pentru a face ajustările necesare.
Având în vedere o ecuație chimică:
Constanta este calculată prin:
Dar dacă inversăm ecuația, obținem ca rezultat:
Și constanta devine inversă:
Pentru a ajunge la ecuația 1, dată în întrebare, trebuie să inversăm ecuația II, ca în exemplul anterior.
Pasul 2: Manipulați ecuațiile II, III și IV pentru a ajunge la rezultatul ecuației I.
Pasul 3: calculați constanta de echilibru a ecuației I.
Calculând KEu se face prin multiplicarea valorilor constante.
Ca și în calcul avem puteri egale de baze, repetăm baza și adăugăm exponenții.
Deoarece acum avem o diviziune cu puteri egale de baze, repetăm baza și scădem exponenții.
8. (UnB) Pentaclorura de fosfor este un reactiv foarte important în chimia organică. Se prepară în faza gazoasă prin reacție:
O sticlă de capacitate de 3,00 L conține la echilibru, la 200 ° C: 0.120 mol PCl5(g), 0,600 mol de PCl3(g) și 0,0120 mol de CL2(g). Care este valoarea constantei de echilibru la această temperatură?
Răspuns corect: 50 (mol / L)-1
Pasul 1: Asamblați expresia constantei de echilibru pentru reacție.
Al doilea pas: calculați concentrațiile în mol / L ale fiecărui component la echilibru.
Formula de concentrație molară:
| PCl3 | Cl2 | PCl5 |
Al treilea pas: înlocuiți concentrațiile în expresia constantă și calculați valoarea lui Kç.
Aplicații pentru echilibrul de echilibru
9. (Enem / 2016) După uzura completă, anvelopele pot fi arse pentru a genera energie. Printre gazele generate în arderea completă a cauciucului vulcanizat, unele sunt poluanți și provoacă ploi acide. Pentru a preveni scăparea lor în atmosferă, aceste gaze pot fi barbotate într-o soluție apoasă care conține o substanță adecvată. Luați în considerare informațiile despre substanță enumerate în tabel.
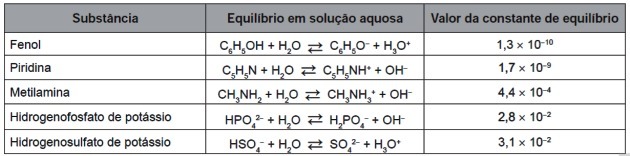
Dintre substanțele enumerate în tabel, cea care este capabilă să elimine cel mai eficient gazele poluante este (a)
a) Fenol.
b) Piridină.
c) Metilamina.
d) hidrogen fosfat de potasiu.
e) hidrogen sulfat de potasiu.
Răspuns corect: d) Fosfat de hidrogen de potasiu.
CO2, oxizi de sulf (SO2 Așadar3) și oxizi de azot (NO și NO2) sunt principalele gaze poluante.
Când reacționează cu apa prezentă în atmosferă, există un formarea acidului care determină o creștere a acidității ploii, motiv pentru care se numește ploaie acidă.
Constantele de echilibru date în tabel sunt calculate prin raportul dintre concentrațiile de produse și reactivi după cum urmează:
Rețineți că constanta de echilibru este proporțională cu concentrația produselor: cu cât este mai mare cantitatea de produse, cu atât este mai mare valoarea Kç.
Rețineți prima și ultima valoare compusă din tabelul pentru Kç:
| piridină | ||
| Hidrogen sulfat de potasiu |
Comparând cele două numere, vedem că cu cât este mai mică puterea negativă, cu atât este mai mare valoarea constantei.
Pentru a elimina poluanții mai eficient, OH- să reacționeze cu ionii H.+ prezent în acizi prin intermediul a reacție de neutralizare.
Printre substanțele prezentate, cele care produc hidroxilii necesari pentru neutralizarea compușilor acizi sunt: piridina, metilamina și hidrogen fosfatul de potasiu.
Pentru a afla care compus este cel mai eficient, observăm constantele de echilibru: cu cât valoarea constantă este mai mare, cu atât este mai mare concentrația de OH-.
Astfel, soluția apoasă care conține o substanță adecvată în acest scop este hidrogen fosfatul de potasiu, deoarece este mai bazic și neutralizează acizii mai eficient.
Pentru a afla mai multe, citiți aceste texte.:
- echilibru ionic
- Reacție de neutralizare
10. (Enem / 2009) Săpunurile sunt săruri ale acizilor carboxilici cu lanț lung utilizate pentru a facilita, în timpul proceselor de spălare, îndepărtarea substanțelor cu solubilitate scăzută în apă, de exemplu uleiuri și grăsimi. Următoarea figură reprezintă structura unei molecule de săpun.
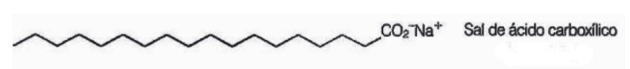
În soluție, anionii săpunului pot hidroliza apa și astfel pot forma acidul carboxilic corespunzător. De exemplu, pentru stearatul de sodiu, se stabilește următorul echilibru:
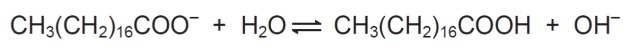
Deoarece acidul carboxilic format este slab solubil în apă și mai puțin eficient în îndepărtarea grăsimilor, pH-ul mediului trebuie controlat în așa fel încât să împiedice deplasarea balanței de mai sus spre dreapta.
Pe baza informațiilor din text, este corect să concluzionăm că săpunurile funcționează într-un fel:
a) Mai eficient la pH de bază.
b) Mai eficient la pH acid.
c) Mai eficient la pH neutru.
d) Eficient peste orice interval de pH.
e) Mai eficient la pH acid sau neutru.
Răspuns: a) Mai eficient la pH de bază.
În balanța prezentată, vedem că stearatul de sodiu atunci când reacționează cu apa formează un acid carboxilic și hidroxil.
Scopul controlului pH-ului nu este de a permite formarea acidului carboxilic, iar acest lucru se face prin schimbarea echilibrului prin schimbarea concentrației de OH-.
cu atât mai mult OH- în soluție, există o perturbare din partea produselor și sistemul chimic reacționează consumând substanța care a avut concentrația sa crescută, în acest caz hidroxilul.
În consecință, va exista transformarea produselor în reactivi.
Prin urmare, săpunurile funcționează cel mai eficient la pH-ul de bază, deoarece excesul de hidroxil deplasează echilibrul spre stânga.
Dacă pH-ul ar fi acid, ar exista o concentrație mai mare de H+ care ar afecta echilibrul consumând OH- iar balanța ar acționa producând mai mult hidroxil, deplasând balanța spre stânga și producând mai mult acid carboxilic, ceea ce nu prezintă interes în procesul prezentat.
Schimbarea echilibrului chimic
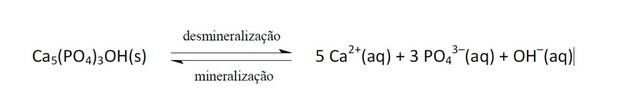
11. (Enem / 2011) Băuturile răcoritoare au devenit din ce în ce mai mult ținta politicilor de sănătate publică. Produsele cu clei conțin acid fosforic, o substanță dăunătoare fixării calciului, mineralul care este componenta principală a matricei dinților. Caria este un proces dinamic de dezechilibru în procesul de demineralizare dentară, pierderea de minerale datorită acidității. Se știe că componenta principală a smalțului dinților este o sare numită hidroxiapatită. Soda, prin prezența zaharozei, scade pH-ul biofilmului (placa bacteriană), determinând demineralizarea smalțului dentar. Mecanismele de apărare salivară durează 20 - 30 de minute pentru a normaliza nivelul pH-ului, remineralizând dintele. Următoarea ecuație chimică reprezintă acest proces:
 GROISMAN, S. Impactul sifonului asupra dinților este evaluat fără a-l scoate din dietă. Disponibil in: http://www.isaude.net. Accesat la: 1 mai 2010 (adaptat).
GROISMAN, S. Impactul sifonului asupra dinților este evaluat fără a-l scoate din dietă. Disponibil in: http://www.isaude.net. Accesat la: 1 mai 2010 (adaptat).
Având în vedere că o persoană consumă zilnic băuturi răcoritoare, poate apărea un proces de demineralizare dentară, din cauza concentrației crescute de
a) OH–, care reacționează cu ionii de Ca2+, deplasarea echilibrului spre dreapta.
b) H+, care reacționează cu hidroxilii OH–, deplasarea echilibrului spre dreapta.
c) OH–, care reacționează cu ionii de Ca2+, deplasarea echilibrului spre stânga.
d) H+, care reacționează cu hidroxilii OH–, deplasarea echilibrului spre stânga.
e) Ca2+, care reacționează cu hidroxilii OH–, deplasarea echilibrului spre stânga.
Răspuns corect: b) H+, care reacționează cu hidroxilii OH–, deplasarea echilibrului spre dreapta.
Când pH-ul scade se datorează faptului că aciditatea a crescut, adică concentrația ionilor H+, așa cum se spune în declarație, există prezența acidului fosforic.
Acești ioni reacționează cu OH- determinând consumul acestei substanțe și, în consecință, deplasarea echilibrului spre dreapta, deoarece sistemul acționează producând mai mulți dintre acești ioni eliminați.
Schimbarea echilibrului dintre reactanți și produse a avut loc din cauza scăderii concentrației de OH-.
Dacă ionii Ca.2+ și oh- în cazul în care concentrația ar crește, ar deplasa echilibrul spre stânga, deoarece sistemul ar reacționa consumându-le și formând mai mult hidroxiapatită.
Modificarea echilibrului anterior, legat de scurgerile de agent frigorific în condițiile descrise, are ca rezultat:
a) Eliberare de CO2 pentru mediu.
b) Creșterea temperaturii recipientului.
c) Ridicarea presiunii interne a recipientului.
d) Creșterea concentrației de CO2 în lichid.
e) Formarea unei cantități semnificative de H2O.
Răspuns corect: a) Eliberare de CO2 pentru mediu.
În interiorul sticlei, dioxidul de carbon a fost dizolvat în lichid datorită presiunii ridicate.
Când sticla este deschisă, presiunea din interiorul recipientului (care a fost mai mare) este egală cu presiunea din mediu și, cu aceasta, există o scăpare de dioxid de carbon.
Schimbarea echilibrului dintre reactanți și produse a avut loc din cauza scăderii presiunii: atunci când presiunea scade, echilibrul se deplasează la cel mai mare volum (numărul de moli).
Reacția sa deplasat spre stânga și CO2 care a fost dizolvat în lichid a fost eliberat, scurgându-se la deschiderea sticlei.
