Analiza volumetrică sau volumetrie este un procedura de laborator în care folosim un anumit volum de a soluţie în concentraţie cunoscut pentru a determina concentrația unei alte soluții. Volumul soluției de concentrație cunoscută va fi determinat atunci când reacționează complet cu soluția de concentrație necunoscută, adică soluțiile implicate trebuie să reacționeze între ele.
Instrumentele cele mai utilizate pentru măsurarea unui volum dat sunt:
- Pipetă

Exemplu de pipetă utilizată la măsurarea volumului
- Biuretă

Bureta este un important echipament de măsurare volumetrică
Măsurarea volumului se face prin evaluarea înălțimii așa-numitului menisc, care nu este altceva decât regiunea de suprafață a lichidului, care prezintă un aspect dreptunghiular sau cupolat (formă de picătură), în funcție de grosimea recipientului. Cu cât containerul este mai lat, cu atât meniscul este mai dreptunghiular; cu cât recipientul este mai subțire, cu atât va fi mai convex. Pentru a evalua meniscul, ochiul trebuie să fie exact la înălțimea sa și trebuie să folosim regiunea inferioară ca referință, dacă meniscul este dreptunghiular sau vârful, dacă este bombat. Vedeți o reprezentare a unei evaluări:
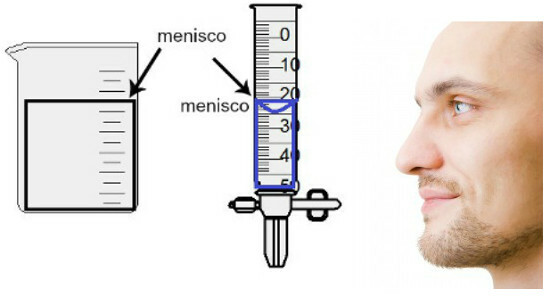
Pentru a evalua un menisc, este important ca ochii dvs. să privească spre el.
În analiza volumetrică, cel mai utilizat echipament este bureta. Acest lucru se datorează faptului că, deoarece metoda implică reacții chimice și acestea pot fi procesate rapid, bureta permite lichidul este eliberat în vârf în picături, ceea ce ne face posibil să oprim lichidul să iasă mai mult controlat.
Una dintre cele mai utilizate proceduri în volumetrie este titrare. Este o analiză volumetrică care implică apariția unei reacții între un acid și o bază sau invers. Echipamentul necesar realizării acestuia este reprezentat în imaginea de mai jos:
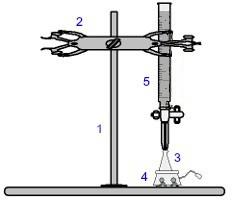
Reprezentarea echipamentului utilizat într-o titrare
Numerele în albastru înseamnă:
1) Suport universal;
2) Gheara (folosita pentru a tine bureta);
3) Erlenmeyer (primește soluția de concentrație necunoscută);
4) Agitator magnetic (utilizat pentru a agita soluția prezentă în balonul Erlenmeyer);
5) Buretă (primește soluția de concentrație cunoscută).
Un volum de soluție de concentrație necunoscută cu indicatorul de fenolftaleină este adăugat în balonul erlenmeyer (imediat soluția va deveni roz). În buretă, se plasează un anumit volum al soluției de concentrație cunoscută. Apoi, soluția acidă din buretă este picurată direct în soluția bazică din balonul Erlenmeyer. Această picurare durează până când soluția de bază devine incoloră, moment în care numim punctul de cotitură, ceea ce indică faptul că toată baza prezentă în soluție a reacționat complet cu acidul.
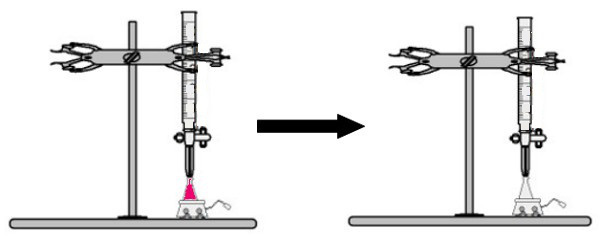
La momentul de cotitură, soluția nu mai este roz și devine incoloră
Observare: Dacă soluția de concentrație necunoscută este acidă, atunci când primește indicatorul de fenolftaleină, va fi incoloră. Astfel, punctul de cotitură în titrare va fi atunci când soluția acidă devine roz la primirea soluției bazice de la buretă.
În cele din urmă, pentru a determina concentrația soluției de bază, trebuie doar să utilizați următoarea ecuație:
Ma.Va = Mb.Vb
Ma = molaritate acidă;
Va = volumul acid;
Mb = molaritatea bazei;
Vb = volumul de bază.
Urmează acum un exemplu al modului în care se efectuează calculul unei soluții cu molaritate necunoscută.
1) 30 ml dintr-o soluție de bază necunoscută au fost adăugați într-un balon Erlenmeyer pentru a efectua o titrare pentru a determina concentrația (molaritatea) acestuia. În buretă s-au adăugat 50 ml de soluție acidă cu o concentrație de 0,2 mol / L. După scăderea soluției acide și până când soluția bazică a fost titrată, s-a observat că la titrare s-au folosit 20 ml soluție acidă. Determinați molaritatea soluției de bază utilizate.
Date despre exerciții:
Vb = 30 ml
Mb =?
Ma = 0,2 mol / L
Va = 20 ml
Deoarece molaritatea acidului și volumul acestuia sunt, respectiv, 0,2 mol / L și 20 mL, iar volumul bazei utilizate este de 30 mL, folosiți doar formula de titrare:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / L
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm

