Sublimarea este schimbarea de la starea solidă la starea gazoasă și invers, fără a trece prin starea lichidă.
Pentru ca o substanță să fie supusă procesului de sublimare, aceasta trebuie să fie supusă anumitor valori de temperatură și presiune.
Naftalină și CO2 solidul (gheața uscată) sunt exemple de substanțe care suferă sublimare în condiții ambientale.

Diagrama fazelor
Putem descoperi starea fizică a unei substanțe cunoscând valorile temperaturii și presiunii la care este supusă.
Pentru aceasta, folosim diagrame construite pentru fiecare substanță, din valori găsite experimental.
Numit „Diagrama fazelor", este împărțit în trei regiuni care reprezintă stările solide, lichide și gazoase. Liniile care delimitează aceste regiuni semnalează punctele în care substanța își schimbă faza.
Punctul triplu din diagramă indică temperatura și presiunea la care substanța poate coexista în cele trei faze. Sub acest punct se află curba de sublimare.
Punctele de pe această curbă determină valorile de presiune și temperatură la care va avea loc sublimarea.
Când un solid este supus unei presiuni mai mici decât punctul triplu, dacă este încălzit, acesta va trece direct într-o stare gazoasă.
Schimbarea de la starea solidă directă la starea gazoasă se poate întâmpla și prin scăderea presiunii atunci când temperatura acesteia este mai mică decât cea a punctului triplu.
Aflați mai multe la: Modificări ale stării fizice.
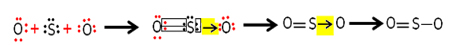
Diagrama fazei dioxidului de carbon (CO)2 )
Punctul triplu al CO2 apare atunci când presiunea este de 5 atm. Acest fapt justifică faptul că este comun să observăm apariția sublimării în gheața uscată, deoarece presiunea ambiantă este de 1 atmosferă.
Din acest motiv, dioxidul de carbon lichid nu se obține în condiții ambientale. În aceste condiții, este fie în stare solidă, fie în stare de vapori.
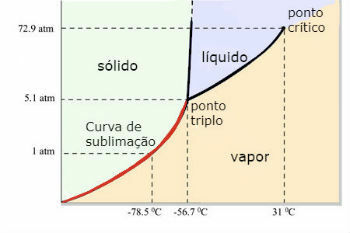
Diagrama fazei apei (H2O)
Punctul triplu al apei apare atunci când presiunea este de numai 0,06 atm. Astfel, în condiții ambientale nu este obișnuit ca apa să se sublimeze.
Pentru a afla mai multe, citiți și:
- Stări fizice ale apei
- Stări fizice ale materiei
- Lichefierea sau condensarea
- Proprietățile materiei
- Solidificare
- Fuziune
- Vaporizare
- Fierbere
- Evaporare