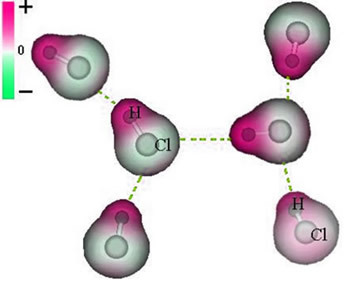
Legătura covalentă apare atunci când doi atomi împărtășesc perechi de electroni pentru a dobândi configurația electronică a unui gaz nobil (cu 8 electroni în carcasa de valență sau cu 2, în cazul celor cu numai carcasa K), conform regulii octet.
Cu toate acestea, există cazuri speciale de legături covalente în care perechea partajată de electroni provine doar de la unul dintre atomii care este deja stabil. Anterior, acest tip de legătură covalentă se numea dativ, astăzi se numește mai frecvent coordona.
Vedeți câteva exemple pentru a înțelege cum se întâmplă acest lucru:
- CO (monoxid de carbon):
Carbonul are 4 electroni în carcasa sa de valență. Prin urmare, conform regulii octetului, pentru a fi stabil, trebuie să mai primească încă 4 electroni, însumând 8. Pe de altă parte, oxigenul are 6 electroni în învelișul de valență și trebuie să primească 2 electroni pentru a obține configurația neonului cu gaz nobil.
Deci, mai întâi, carbonul și oxigenul împart două perechi de electroni, astfel încât oxigenul să fie stabil:
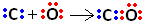
Cu toate acestea, carbonul rămâne instabil deoarece are încă 6 electroni și are nevoie de 2. Prin urmare, oxigenul, care este deja stabil, împărtășește una dintre perechile sale de electroni cu carbonul, adică face o legătură dativă cu acesta, făcându-l stabil:

Rețineți că legătura covalentă de coordonate poate fi reprezentată printr-o liniuță, la fel ca legătura covalentă comună.
- NUMAI2 (Dioxid de sulf):
Fiecare atom de sulf și oxigen are 6 electroni în cochiliile lor de valență, deci trebuie să primească 2 electroni fiecare. Inițial, sulful face două legături covalente comune, împărtășind două perechi de electroni cu unul dintre atomii de oxigen, ambii rămânând stabili cu 8 electroni.
Nu te opri acum... Există mai multe după publicitate;)
Dar celălalt atom de oxigen nu este stabil, astfel încât sulful împarte o pereche de electroni cu el printr-o legătură covalentă coordonată sau dativă:
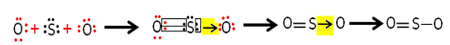
Rețineți că, în acest caz, avem trei atomi în moleculă, deci poate exista o migrație a legăturii de la un atom la altul. Molecula de dioxid de sulf poate fi, de asemenea, reprezentată astfel: O ─ S ═ O.
Numim acest fenomen de legătură rezonanţă. Vedeți încă trei exemple în tabelul de mai jos:
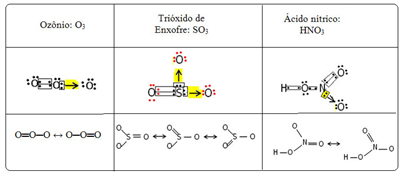
Se numesc structuri posibile structuri de rezonanță sau forme canonice.
Acest tip de legătură apare și în formarea ionilor, ca în cazul ionilor de hidroniu (H3O+) și amoniu (NH4+).
În primul rând, cationul H.+ se formează atunci când hidrogenul își pierde singurul electron, lăsându-l cu o sarcină pozitivă. Deci va trebui să primească doi electroni pentru a fi stabil. Acest lucru se întâmplă printr-o legătură dativă cu apă (în cazul ionului de hidroniu) și cu amoniac (în cazul ionului de amoniu). Ceas:

De Jennifer Fogaça
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Legătură covalentă dativă sau coordonată”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm. Accesat la 28 iunie 2021.