Așa cum se explică în text „Cataliză și catalizator”, Catalizatorii sunt specii chimice care accelerează viteza reacțiilor. Utilizarea sa este foarte utilă în industriile chimice, unde se caută să economisească cât mai mult timp posibil în producție.
Cu toate acestea, în anumite situații este mai interesant faptul că reacția se desfășoară mai încet; ca, de exemplu, atunci când doriți să determinați viteza reacțiilor foarte rapide. Pentru a realiza acest lucru, controlând și studiind aceste reacții, este obișnuit să adăugați o substanță care încetinește reacțiile, care se numesc inhibitori, otrăvuri sau anticatalizatori.
Aceste specii chimice se combină cu catalizatorul, anulând sau scăzând acțiunea acestuia. Acest lucru este posibil deoarece mecanismul de acțiune al catalizatorului este de a reduce energia de activare, facilitând procesul de reacție și mărind viteza acestuia; deja inhibitorii acționează invers, ceea ce înseamnă că măresc energia de activare necesară reactanților pentru a ajunge la complexul activat.
Un exemplu care poate fi menționat este arsenicul (As), care are această funcție în reacția Haber-Bosch, o reacție utilizată pe scară largă în industrie pentru producerea de amoniac, folosind fier (Fe(s)) ca catalizator al acestuia. Astfel, eficiența fierului devine foarte mică în prezența arsenului, care îl inhibă, adică este otravă catalizatoare a acestei reacții, care este prezentată mai jos:
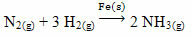
Arsenicul poate exercita, de asemenea, o acțiune anticatalitică atunci când se utilizează platină metalică (Pt(s)) ca catalizator al reacției de ardere SO2 (g), pentru producerea de trioxid de sulf (SO3 (g)). Prezența arsenicului, chiar și în cantități mici, anulează acțiunea catalitică a platinei, care poate paraliza o parte din producție. De aceea, în mod normal, în industriile care se ocupă de această producție, se utilizează pentoxid de divanadiu (V2O5 (e)) ca catalizator în locul platinei.
Nu te opri acum... Există mai multe după publicitate;)
Un alt exemplu apare în următoarea reacție de descompunere a peroxidului de hidrogen:
2 ore2O2 (aq) → 2 H2O(1) + 1 O2 (g)
În acest caz, un inhibitor care poate fi utilizat este un pic de acid, deoarece atunci când mediul este acid, reacția se desfășoară mai lent.
Dar inhibitorul este, de asemenea, utilizat pe scară largă de către industrie, în principal pentru a acționa ca un inhibitor de reacție al degradării naturale a alimentelor, băuturilor, produselor cosmetice și medicamentelor.
Cosmetica, de exemplu, poate dura mult până ajunge la consumator; astfel, în aceștia se utilizează diverși conservanți, cum ar fi propilparabenul, care este utilizat în faza uleioasă și acționează ca antifungic, și metilparabenul, care este utilizat în faza apoasă și care are un efect antiseptic. Structurile lor respective sunt prezentate mai jos:
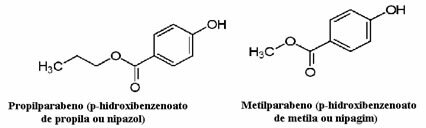
Este interesant faptul că pe multe etichete cosmetice există următoarea frază: „Nu conține parabeni”. Aceasta înseamnă că acest produs cosmetic nu are acești conservanți pe care i-am menționat și că, în mod normal, nu au fost testați pe animale.
De Jennifer Fogaça
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Inhibitori de catalizator”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/inibidores-catalisador.htm. Accesat la 27 iunie 2021.


