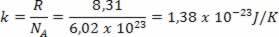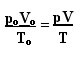În anii 1920, modelul atomic al lui Bohr fusese deja prezentat lumii, dar a suferit încă îmbunătățiri care au avut participarea altor fizicieni. Cel care s-a remarcat cel mai mult în studiile legate de îmbunătățirea modelului atomic al lui Bohr a fost fizicianul german Arnold Sommerfeld.
Spin s-a născut dintr-o încercare de a înțelege și explica de ce spectrul hidrogenului și al altor atomi avea mai multe linii, cum ar fi efectul Zeeman.
Au ajuns apoi la concluzia că rotirea este mișcarea unghiulară a electronului, adică mișcarea electronului are orbite eliptice, care respectă legile lui Kepler și sunt responsabile pentru tranziția diferențelor mici în energie.
Înainte de descoperirea spinului electronului, orbita atomului analizat se făcea prin numere cuantice. Ei au fost responsabili de relaționarea nivelurilor de energie ale electronului, forma orbitală deținută de electron și, de asemenea, descrierea cuantificării spațiale făcută de acesta.
În 1925, fizicianul austriac Wolfgang Pauli, când a analizat spectre, a observat că numărul de electroni nu a fost repetat în același atom. Deoarece în fiecare orbital există doar doi electroni, aceștia trebuie neapărat să aibă energii diferite.
Paulli a postulat excluderea spinului când a observat că electronul are aceeași cantitate de numere cuantice în același atom, definind astfel structura electronică a atomilor.
Nu te opri acum... Există mai multe după publicitate;)

De Talita A. îngeri
Absolvent în fizică
Echipa școlii din Brazilia
Fizică Modern - Fizică - Școala din Brazilia
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
ÎNGERI, Talita Alves dos. „Rotația electronică și principiul excluderii”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/fisica/o-spin-eletron-principio-exclusao.htm. Accesat la 28 iunie 2021.