Savantul Friedrich Kohlrausch (1840-1910) a fost primul care a propus că apa pură conduce electricitatea, deși la scară mică. Acest lucru se datorează faptului că apa se comportă într-un mod amfoteric; adică, în anumite ocazii, acționează ca acid, donând protoni (H+); iar în altele se comportă ca o bază, primind protoni.
Aceasta înseamnă că apa își efectuează propria ionizare, în conformitate cu ecuația chimică prezentată mai jos:
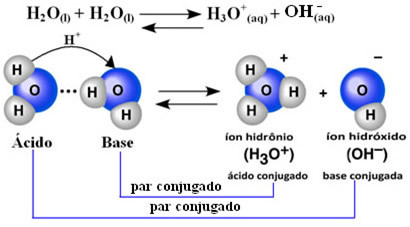
Acest proces se numește autoionizarea apei și apare la o scară foarte mică, adică apa este un electrolit foarte slab, cu valori scăzute ale gradului de ionizare și constantei de ionizare la echilibru (Kç). Tocmai de aceea apa are o conductivitate atât de scăzută.
Pentru a vă face o idee, la o temperatură ambiantă de 25 ° C este posibil să se determine că concentrațiile ionilor de hidroxid și hidroniu produse în auto-ionizarea apei pure sunt egale cu 1. 10-7 mol. L-1. Aceasta înseamnă că dintr-un miliard de molecule de apă, doar două se ionizează.
Constanta echilibrului ionic al apei se numește
çconstanta de disociere a apei,constanta autoprotolizeisau produs ionic al apei.Această constantă este reprezentată de Kw, deoarece w se referă la cuvânt apă, care în engleză înseamnă apă.Nu te opri acum... Există mai multe după publicitate;)
Calculul său se face în același mod ca și celelalte constante de echilibru, amintindu-ne că, așa cum se spune în textul "Constante ale Bilanț Kc și Kp ”, în acest caz, numai produsele vor apărea în expresie, deoarece apa în stare lichidă are aceeași activitate la 1. Substanțele lichide sau solide pure nu sunt introduse în expresia constantă de disociere deoarece nu se schimbă. Sunt plasate doar soluții apoase și gazoase. Deci avem:
Kw = [H3O+]. [Oh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Ca și în cazul celorlalte constante de echilibru, O.Kw se schimbă numai odată cu schimbarea temperaturii. Pe măsură ce temperatura apei crește, crește și ionizarea acesteia, ceea ce înseamnă că auto-ionizarea apei este un proces endoterm, adică absoarbe căldura.
Acest lucru poate fi văzut în valorile produsului ionic al apei (Kw) prezentate în tabelul de mai jos la diferite temperaturi:
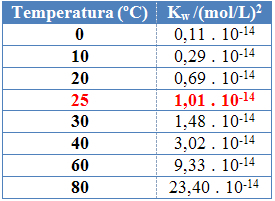
Produsul ionic al apei va avea întotdeauna o valoare fixă la fiecare temperatură, fie în apă pură, fie în soluție. Chiar dacă soluția are concentrații de ioni H3O+ și oh- diferit, produsul dintre ele va rămâne constant.
De Jennifer Fogaça
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Produs de apă ionică (Kw)”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Accesat la 28 iunie 2021.



