jest nazywany wiązka jonów wielkość jonu. Badanie tej właściwości jest uzależnione od wiedzy o promieniu atomowym i jonach.
Promień atomowy: jest miarą wielkości neutralnego atomu (teoretyczna odległość od jądra do ostatniej elektrosfery).
jony: atomy, które tracą (kationy) lub zyskują elektrony (aniony).
Protony wewnątrz jądra a atom wywierać przyciągającą siłę na elektrony (ujemne cząstki) obecne w elektrosferach. Im większa liczba protonów, tym większa ta atrakcja i odwrotnie. Gdy liczba elektronów w atomie jest modyfikowana przez utratę lub wzmocnienie tych cząstek, przyciąganie między protonami i elektronami zmienia się w następujący sposób:
W przypadku kationu:
Liczba elektronów w elektrosferach staje się mniejsza niż liczba protonów wewnątrz jądra, co sprawia, że siła przyciągania jądra jest większa, przyciągając do niego elektrony. elektrosfery. Rezultatem jest zmniejszenie promienia atomu. Tak więc promień kationu będzie zawsze mniejszy niż promień jego neutralnego atomu.
Promień neutralnego atomu > Promień kationu
W przypadku anionu:
Liczba elektronów w elektrosferach staje się większa niż liczba protonów wewnątrz jądra. W tym przypadku siła przyciągania wywierana przez jądro jest pokonywana przez siłę odpychania między elektronami obecnymi w elektrosferach, co powoduje wzrost promienia atomu. Tak więc promień anionu będzie zawsze większy niż promień jego neutralnego atomu.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Promień anionów > Promień neutralnego atomu
Dwie przedstawione poniżej sytuacje są dobrym przykładem tego, co dzieje się z promieniem jonu:
1.) Neutralny atom sodu (11Na) i kation sodu (11W+)
Podczas gdy neutralny atom sodu ma jedenaście protonów (żółte kule) i jedenaście elektronów (czerwone kule), kation sodu ma jedenaście protonów i dziesięć elektronów.

Model atomu neutralnego sodu
Kiedy neutralny atom sodu traci elektron, promień maleje.
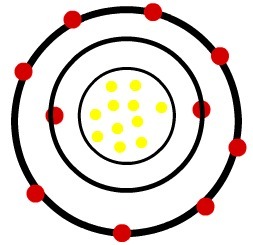
Model kationu sodu
Obserwacja: Trzeci poziom nie był reprezentowany w obrazie kationu, ponieważ tracąc jedyny posiadany elektron, stał się pusty i dlatego został pominięty, ale jest obecny.
2.) Fosfor neutralny atom (15P) i kation fosforu (15P-3)
Podczas gdy neutralny atom fosforu ma piętnaście protonów (żółte kule) i piętnaście elektronów (czerwone kule), anion fosforu ma piętnaście protonów i osiemnaście elektronów.
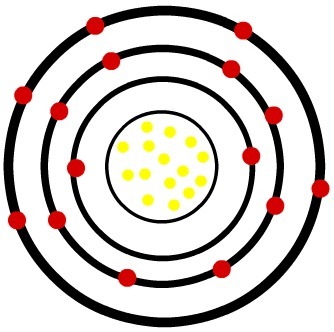
Model neutralnego atomu luminoforu
Kiedy obojętny atom fosforu zyskuje trzy elektrony, promień wzrasta.
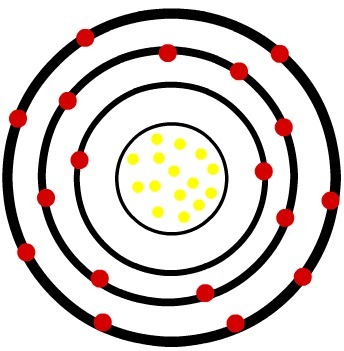
Model anionu luminoforu
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Promień jonowy”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/raio-ionico.htm. Dostęp 28 czerwca 2021 r.