Jeden reakcja utleniania w związkach organicznych występuje, gdy występuje wlot tlenu (lub wydzielanie wodoru) w cząsteczce organicznej.
| Jeden łagodne utlenianie występuje tylko w węglowodorach z nienasycenie, czyli z podwójnymi (alkenami) lub potrójnymi (alkinowymi) wiązaniami. |
Aby węglowodory nasycone uległy utlenieniu, potrzebne jest bardziej energetyczne utlenianie.
Łagodne utlenianie wykorzystuje Baeyer reaktywne, co odpowiada wodnemu roztworowi nadmanganianu potasu (KMnO4) w obojętnym lub lekko zasadowym (zasadowym – OH1-), zimnym ośrodku. Ta reaktywna jest tak nazywana, ponieważ niemiecki chemik Adolf Von Baeyer zaproponował test o nazwie Test Baeyera, do identyfikacji alkenów i ich izomerów cyklanu.
Ten test działa w następujący sposób: jak zobaczymy później, alken reaguje z nadmanganianem potas, stąd jego kolor, początkowo fioletowy, staje się bezbarwny i pojawia się osad brązowy (MnO2). Jednak cyklany nie reagują z nadmanganianem potasu. Więc jeśli roztwór pozostaje fioletowy, jest to cyklan.
Poniższy rysunek pokazuje, że test był pozytywny dla alkenów tylko w lewej probówce, ponieważ pojawił się brązowy osad.
Teraz nie przestawaj... Po reklamie jest więcej ;)

Reakcja utleniania alkenów rozpoczyna się od rozkładu nadmanganianu, w wyniku którego powstaje tlen:
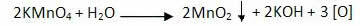
Łagodne utlenianie alkenów:
Ten wytworzony tlen będzie reagował z podwójnym wiązaniem alkenu tworząc epoksyd który później, poprzez hydrolizę, staje się alkohol lub wicynalny diol (glikol), czyli dwie grupy OH na sąsiednich węglach.
W poniższym przykładzie widzimy łagodne utlenianie propenu:
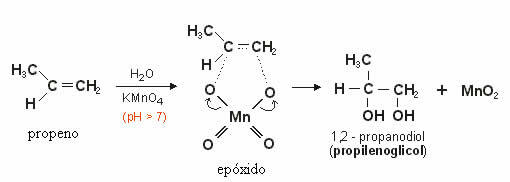
Łagodne utlenianie alkinów:
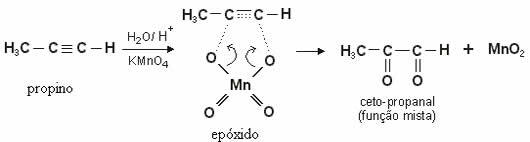
W przypadku alkiny, utworzony produkt będzie diketony. Z wyjątkiem etyn (HC≡CH), gdzie są dwa wodory związane z każdym węglem uczestniczącym w wiązaniu potrójnym, a aldehyd.
Zwróć uwagę na łagodne utlenianie propynu z utworzeniem diketonu:
Jennifer Fogaça
Absolwent chemii
Brazylijska drużyna szkolna
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Miękkie utlenianie”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/oxidacao-branda.htm. Dostęp 28 czerwca 2021 r.



