O Schemat faz to wykres używany do wskazania warunków temperaturowych i nacisk potrzebne, aby uzyskać substancja w pewnym stan fizyczny (solidny, ciekły lub gazowe).
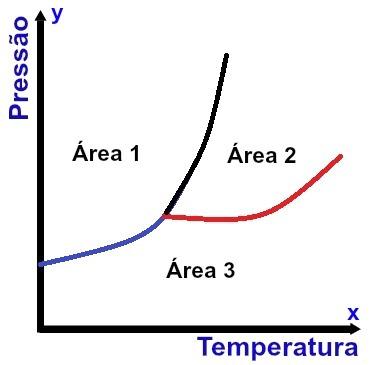
Reprezentacja diagramu fazowego
Oś x (pozioma) zawiera wartości temperatury, a oś y (pionowa) wartości ciśnienia. Ponadto istnieją trzy krzywe połączone z jednym punktem (zwanym potrójnym punktem), dzielące wykres na trzy dobrze zdefiniowane obszary, jak widać na powyższym schemacie.
Oprócz wskazania warunków, w których substancja ma być w określonym stanie fizycznym, Schemat faz wskazuje warunki, w których mogą wystąpić zmiany stanu fizycznego.
Zmiany stanu fizycznego to:
Połączenie: przejście ze stanu stałego do stanu ciekłego;
Zestalenie: przejście ze stanu ciekłego do stanu stałego;
Odparowanie: przejście ze stanu ciekłego do stanu gazowego;
Kondensacja: przejście ze stanu gazowego do ciekłego;
Sublimacja: przejście ze stanu stałego do stanu gazowego;
Resublimacja: przejście z gazu do stanu stałego.
a) Regiony
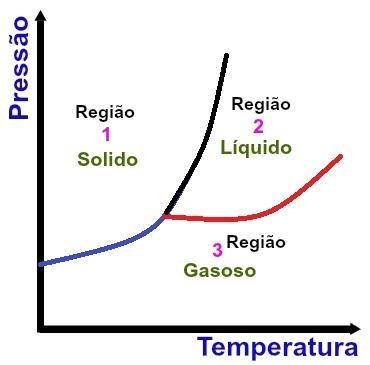
Podstawowe obszary diagramu fazowego
Region 1
Region 1 wskazuje warunki temperatury i ciśnienia, w których znajdujemy substancję w stanie stałym.
Region 2
Region 2 wskazuje warunki temperatury i ciśnienia, w których znajdujemy substancję w stanie ciekłym.
Region 3
Region 3 wskazuje warunki temperatury i ciśnienia, w których znajdujemy substancję w stanie gazowym.
b) Krzywe

Krzywe obecne na diagramie fazowym
Krzywa A (fioletowa krzywa)
Jest to krzywa dzieląca obszar stały i gazowy diagramu fazowego i jest powszechnie nazywana krzywą resublimacji. Każdy punkt znajdujący się na krzywej 1 wskazuje, że mamy pewną substancję współistniejącą w stanie stałym i gazowym.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Oprócz wskazania współistnienia, krzywa 2 wskazuje również warunki temperatury i ciśnienia dla przekształcenia substancji ze stanu ciekłego w stan gazowy.
Krzywa B (czarna krzywa)
Jest to krzywa, która dzieli obszar stały i ciekły diagramu fazowego i jest powszechnie nazywana krzywą krzepnięcia. Każdy punkt znajdujący się na krzywej 2 wskazuje na współistnienie pewnej substancji w stanie stałym i gazowym.
Oprócz wskazania współistnienia, krzywa 2 wskazuje również warunki temperatury i ciśnienia dla przekształcenia substancji znajdującej się w stanie ciekłym w stan stały.
Krzywa C (czerwona krzywa)
Jest to krzywa, która dzieli obszar stały i gazowy diagramu fazowego i jest powszechnie nazywana krzywą kondensacji. Każdy punkt znajdujący się na krzywej 3 wskazuje na współistnienie pewnej substancji w stanie stałym i gazowym.
Oprócz wskazania współistnienia, krzywa 3 wskazuje również warunki temperatury i ciśnienia dla przemiany substancji ze stanu stałego w stan gazowy i odwrotnie.
c) Punkt potrójny
Punkt, w którym spotykają się trzy krzywe na diagramie fazowym, nazywany jest punktem potrójnym. W tym momencie mamy wartość temperatury i wartość ciśnienia, przy której znajdujemy jednocześnie substancję w stanie stałym, ciekłym i gazowym.

d) Zmiany stanu fizycznego na wykresie fazowym
Na poniższym diagramie fazowym mamy 6 strzałek, które wskazują kierunek zmian stanów fizycznych substancji.

Strzałka 1: wskazuje połączenie
Strzałka 2: wskazuje krzepnięcie
Strzałka 3: wskazuje waporyzację
Strzałka 4: wskazuje kondensację
Strzałka 5: wskazuje na sublimację
Strzałka 6: wskazuje na resublimację
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Co to jest diagram fazowy?”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diagrama-fases.htm. Dostęp 28 czerwca 2021 r.
Chemia

Przemiany cieczy, parowanie, siły międzycząsteczkowe, superzamrażanie cieczy, krystalizacja cieczy, hartowanie, lepkość cieczy, ciśnienie pary cieczy, ciśnienie atmosferyczne, zamrażanie cieczy, temperatura
Chemia

Ciecze, napięcie powierzchniowe, stapianie ciała stałego, kondensacja gazu, lepkość, płyn, stała objętość, cząsteczki gazu, siły międzycząsteczkowe, kompresja, parowanie cieczy.

