Wzór strukturalny to sposób na przedstawienie wiązań między pierwiastkami, przy czym każda para elektronów dzielonych między dwoma atomami jest symbolizowana przez myślnik:
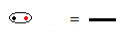
Wspólna para elektronów symbolizowana przez myślnik
Oznacza to, że we wzorze strukturalnym występują wszystkie rodzaje wiązań kowalencyjnych, zarówno pojedyncze, podwójne, jak i potrójne:
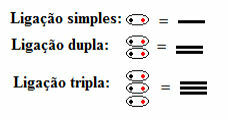
Wiązania pojedyncze, podwójne i potrójne symbolizowane przez myślniki we wzorach strukturalnych
Spójrz na kilka przykładów wzorów strukturalnych małych cząsteczek zawierających niewiele wiązań i zauważ, jak reprezentowane są wspólne pary elektronów.
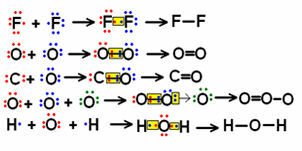
Przykłady wzorów strukturalnych dla niektórych cząsteczek
Wzory pokazane powyżej po lewej stronie, w których pary elektroniczne są symbolizowane przez „kropki”, nazywają się formuły elektroniczne lub Wzory Lewisa. Wszystkie te cząsteczki są substancjami nieorganicznymi, ale wzory strukturalne są na ogół częściej stosowane w przypadku związków organicznych, które: to te utworzone przez pierwiastek węgiel, które nie są pochodzenia mineralnego (jak w przypadku tlenku węgla (CO), który jest uważany nieorganiczny).
Ponieważ węgiel jest czterowartościowy (tworzy cztery wiązania kowalencyjne), ma dużą zdolność do wiązania się z różnymi atomami i innymi węglami, tworząc nieskończoność łańcuchów węglowy. Dlatego wzór strukturalny jest ważny, ponieważwskazuje układ atomów w łańcuchu.
Aby zrozumieć, rozważ następujące kwestie: formuła molekularna wskazuje tylko liczbę każdego pierwiastka w cząsteczce substancji. Załóżmy na przykład, że mamy wzór cząsteczkowy C3H6, wiemy wtedy, że ma trzy atomy węgla i sześć atomów wodoru, ale jak są one połączone? Wzór strukturalny powie nam to i rzeczywiście możemy dowiedzieć się, który to związek. Należy zauważyć, że ten wzór cząsteczkowy może dać początek dwóm różnym wzorom strukturalnym, a w konsekwencji dwóm różnym substancjom:

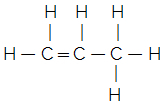
Cyklopropan Propen
Można je nazwaćpłaskie wzory strukturalne, w którym wszystkie połączenia i wszystkie elementy są narysowane na płaszczyźnie papieru, tablicy, ekranu komputera itp.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Jednak wiele łańcuchów węglowych jest bardzo dużych i dość złożonych, więc trudno byłoby za każdym razem pisać wzór strukturalny płasko.
W ten sposób powstały inne, bardziej uproszczone, formy reprezentacji struktury molekuł. Pierwszym z nich jest uproszczony lub skrócony wzór strukturalny, w którym ilość atomów wodoru przyłączonych do każdego węgla jest skrócona przez umieszczenie jego symbolu (H) tylko raz i dodając w prawym dolnym rogu indeks, czyli liczbę, która pokazuje ile wodorów jest.
Rozważmy na przykład płaski wzór strukturalny zwykłego eteru:
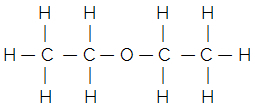
Jego uproszczony lub skrócony wzór strukturalny wyraża się wzorem:
H3C — CH2 — O — CH2 — CH3
Dużo prostsze, prawda?!
Ale wiedząc, że węgiel zawsze tworzy cztery wiązania, a wodór tworzy tylko jedno wiązanie, pojawiła się inna, jeszcze prostsza formuła, którą jest formuła z kresek. Jeśli chcesz, możesz zobaczyć, jak to napisać bardziej szczegółowo w tekście Wzory molekularne związków organicznych. Ale w zasadzie w tym wzorze pomija się grupy C, CH, CH2 i CH3, które są reprezentowane przez myślniki połączone zygzakiem. Poniżej mamy wzór strukturalny wspomnianego eteru:
Wspólna formuła śladowa eteru
Prawdą jest jednak, że formuły substancji nie są dokładnie płaskie w przestrzeni. Dlatego w niektórych przypadkach, aby nadać bardziej przestrzenny pomysł, piszą formuły w perspektywie, gdzie linki mogą wskazywać czy atom znajduje się w płaszczyźnie (skok normalny), za płaszczyzną (kropkowany klin) czy przed płaszczyzną (pełny klin):

Reprezentacje w formułach w perspektywie
Na przykład spójrz na poniższy wzór kortyzolu. Zauważ, że jeden wodór, jedna grupa hydroksylowa (OH) i dwie grupy metylowe (CH3 – które są pominięte) są przed samolotem, podczas gdy dwa wodory i grupa hydroksylowa są za samolotem, a reszta jest w samolocie.

Wzór strukturalny w perspektywie kortyzolu
Jennifer Fogaça
Absolwent chemii
Wzory chemiczne, wzór strukturalny płaski, wzór strukturalny Coupera, wiązanie potrójne, gaz azot, wzór elektroniczny, wzór Lewisa, wzór cząsteczkowy, wiązanie pojedyncze, wiązanie podwójne, gaz węglowy.