TEN Most solny został zaproponowany przez angielskiego chemika Frederica Daniella w 1836 roku, kiedy ten uczony założył bateria nazwany jego imieniem (Danill's Pile). ten most!??? to rura w kształcie litery U, która ma dwa porowate końce. (składający się z bawełny lub agar-agar) i zawiera wodny roztwór utworzony z wody i soli. Pośrednio łączy roztwory dwóch półogniw ogniwa (anody i katody).
Obserwacja: Anoda jest biegunem ujemnym akumulatora i jest miejscem utleniania, a katoda biegunem dodatnim i miejscem redukcji.
Aby zrozumieć znaczenie mostu solnego, najpierw trzeba zrozumieć działanie pala. Zobacz poniższy schemat:
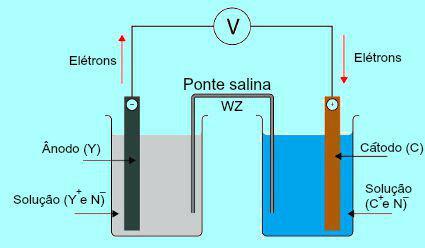
Ogólny schemat stosu Daniella
Początkowo metal (Y) płytki obecny w anodzie ulega utlenianiu. Podczas utleniania metal zamienia się w kation, który wpada do roztworu, w którym znajduje się płyta. Z tego powodu roztwór anodowy zaczyna wykazywać wyższe stężenie kationów (Y+). W tym przypadku obserwuje się spadek metalowej płyty anody.
T → i- + Y+
Następnie elektrony utracone podczas utleniania metalu płyty anodowej przechodzą przez zewnętrzny przewód elektryczny i trafiają do metalowej płyty znajdującej się w katodzie. W ten sposób płyta znajdująca się na katodzie zostaje naładowana elektronami.
-
Obecne kationy (C+) w roztworze poruszaj się w kierunku płytki katodowej, ponieważ jest ona naładowana elektronami. Kationy, pozyskując elektrony obecne w płytce, stają się obojętne (stabilne i stałe) i przywierają do niej. Z tego powodu roztwór katodowy wykazuje wyższe stężenie anionów niż kationów. W tym przypadku obserwuje się wzrost wielkości metalowej płytki katody.
Teraz nie przestawaj... Po reklamie jest więcej ;)
DO+ + i- → C
Od zrozumienia, w jaki sposób stos Daniella, można zaobserwować, że roztwór obecny w anodzie otrzymuje większą ilość kationów Y+ ze względu na utlenianie metalu płyty X. Natomiast roztwór obecny w katodzie traci kationy (C+), ponieważ cierpią na zmniejszenie płytki nazębnej.
Właśnie na ten temat podkreśla się pracę solnego mostu. Główną funkcją tego mostka jest promowanie równowagi ładunków obecnych zarówno w roztworach anodowych, jak i katodowych. W mostku solnym zawsze mamy sól (zazwyczaj chlorek potasu lub azotan amonu.) zdysocjowaną w wodzie. Zobacz reprezentację równania w moście solnym:
WZ + H2O → W+ + Z-
W moście solnym znajdują się dwa jony (W+ i Z-), które są przesunięte na katodę i anodę zgodnie z:
) Anoda otrzymuje aniony (Z-) obecne w mostku solnym na skutek utlenienia pierwiastka (Y), co powoduje wzrost ilości kationów (Y+) w rozwiązaniu.
B) Katoda odbiera kationy (W+) mostka solnego, ponieważ podczas pracy bateryjnej kation (C+) obecny w rozwiązaniu jest zmniejszony na tablicy. Zatem roztwór katodowy ma większą ilość anionów (N-), a zatem otrzymuje kation obecny w mostku solnym.
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Most żaglowy”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Dostęp 28 czerwca 2021 r.
