Kwasy są substancjami, które jonizować w środowisku wodnym i są dobre przewodniki moc. Kwasowość substancji można zmierzyć za pomocą technik pomiaru potencjału jonów wodorowych (pH) rozwiązania. Niektóre metody analityczne pH wykorzystują wskaźniki, takie jak lakmus lub fenoloftaleina, które odzwierciedlają wartość pH roztworu w kolorze.
Kwasy można scharakteryzować:
przez obecność lub brak tlenu w jego cząsteczce;
siłą;
przez jonizujące wodory;
przez jego zmienność.
Przeczytaj też:Porównanie kwasów i zasad - różnice i właściwości
Charakterystyka kwasów
Jonizują się w środowisku wodnym, uwalniając kation H+.
Są przewodnikami prądu elektrycznego z powodu uwolnienia jony w środowisku wodnym.
W kontakcie z podstawowym środowiskiem cierpią Reakcja neutralizacji, tworząc sól i wodę jako produkty tej reakcji.
Zmieniają kolor roztworu w obecności substancji wskaźnikowej, takiej jak lakmus lub fenoloftaleina.
Kwaśny smak cytryny, pomarańczy i innych owoców cytrusowych jest spowodowany kwasem obecnym w tych produktach.
Potencjał wodoru (pH)
Potencjał jonów wodorowych (pH) to obliczenie, które wyraża stężenie jonów wodór w pewnym rozwiązanie. Aby określić pH i przeanalizować pożywkę, brane są pod uwagę:
prawo rozcieńczenia Ostwalda (im bardziej rozcieńczone, tym więcej jonów utworzy się w roztworze);
autojonizacja wody (Kw), czyli naturalny rozkład cząsteczki H2O w jonach H+ i och-;
woda destylowana o temperaturze 25°C ma autojonizację Kw = 10-14 i to samo stężenie jonów H+ i och-, czyli jest to neutralne medium.
Do obliczenia pH z uwzględnieniem stężenia H+, posługiwać się: pH = -log[H+].
Wiedz, że:
pH > 7 → roztwór zasadowy
pH < 7 → roztwór kwaśny
pH = 7 lub pH = pOH → roztwór obojętny
Zobacz też: Jakie są formuły kwasowe?

Klasyfikacja kwasów
TEN klasyfikacja kwasowa można to zrobić biorąc pod uwagę cztery różne kryteria.
Stopień jonizacji (α) lub siła kwasu
α = liczba zjonizowanych cząsteczek
liczba rozpuszczonych cząsteczek
Silne kwasy: α ≥ 50%.
Przykład: ákwas siarkowy (H2TYLKO4) → α = 61%.Kwasy półmocne lub umiarkowane: 5% < α < 50%.
Przykład: kwas fosforowy (H3KURZ4) → α = 27%.Słabe kwasy: α ≤ 5%.
Przykład: kwas borowy (H3BO3) → α = 0,075%.
→ Liczba jonizowalnego wodoru
monokwas: uwalnia kation H+.
Przykład: ákwas chlorowodorek (HCL);
dikwas: uwalnia dwa kationy H+.
Przykład: siarkowodór (H2S).trikwas: uwalnia trzy kationy H+.
Przykład: kwas borowy (H3BO3).tetracyd: uwalnia cztery kationy H+.
Przykład: kwas pirofosforowy (H4P2O7).
Uwaga! W przypadku hydrokwasów wszystkie wodory w cząsteczce są podatne na jonizację; ale w przypadku kwasów tlenowych tylko wodory, które są związane z atomem tlenu, są podatne na jonizację. Przykładem jest kwas podfosforawy (H3KURZ2), który jest monokwasem, ponieważ pomimo obecności w swoim składzie trzech wodorów, uwalnia tylko wodór związany z tlen.
→ Obecność tlenu
kwasy tlenowe: mają w swojej strukturze tlen.
Przykład: kwas podchlorawy (HO Cl).
Hidrakidy: nie zawierają tlenu w swojej strukturze.
Przykład: kwas fluorowodorowy (HF).
→ Zmienność
Naprawiony: temperatura wrzenia(STOPA) > 100°C, powoli przechodząc w stan gazowy.
Przykład: kwas siarkowy (H2TYLKO4) → PE = 340 °C.lotne: temperatura wrzenia < 100°C, szybko i łatwo przechodzi w stan gazowy.
Przykład: siarkowodór (H2S) → PE = -59,6°C.
Nomenklatura kwasów
→ Hidrakwasy
Kwas + nazwa anionu + hydric
W przypadku wszystkich kwasów termin „kwas” jest używany przed nomenklaturą charakteryzującą cząsteczkę. W kwasach bezwodnikowych sufiks „eto” nazwy pierwiastka zastępuje się „wodorotlenowym”.
Przykłady:
HCl → kwas chlorhydrauliczny
HBr → kwas bromhydrauliczny
HF → kwas fluorhydrauliczny
→ kwasy tlenowe
Nomenklatura kwasów tlenowych zmienia się w zależności od stopień utlenienia (NOX) centralnego elementu. Zobacz tabelę poniżej:
NOX elementu centralnego |
Nomenklatura kwasów |
||
prefiks- |
-infiks- |
-przyrostek |
|
+1 i +2 |
Hipopotam- |
-nazwa anionu- |
-so |
+3 i +4 |
-- |
Nazwa anionu- |
-so |
+5 i +6 |
-- |
Nazwa anionu- |
-ic |
+7 |
Za |
-nazwa anionu- |
-ic |
Przykłady:
HCIO → Wiedząc, że wodór (H) normalnie ma NOX +1, a tlen (O) ma NOX -2, abyśmy mieli cząsteczkę o ładunku 0, chlor (Cl) musi mieć NOX +1, więc nomenklatura tego kwasu jest kwas podchlorawy.
HNO2 → kwas azotawy
HClO4 →ákwasnadchlorowy
→ Wyjątki od reguły
H2CO3 → kwas węglowy, a nie węglowe, jak to miałoby miejsce w regule NOX.
H3BO3 → ákwas borowy, i nie nudne.
Kwasy w życiu codziennym
Nawozy i leki: Kwas fosforowy (H3KURZ4) jest szeroko stosowany w produkcji nawozów, a także jako lek. Jest jednym z kilku kwasów stosowanych w branży farmaceutycznej.
Owoce cytrusowe: mieć kwas askorbinowy (C6H8O6), znany również jako Witamina C.
Ocet winny: ma w swoim składzie Kwas octowy (CH3COOH).
- Woda gazowana i napoje bezalkoholowe: składa się z kwasu węglowego (H2WSPÓŁ3), co daje produktowi uczucie orzeźwienia.
Również dostęp:Rola kwasów w napojach bezalkoholowych

rozwiązane ćwiczenia
Pytanie 1 - (Enem) Sok wyciśnięty z czerwonej kapusty może służyć jako wskaźnik kwaśnego (pH od 0 do 7) lub zasadowego (pH od 7 do 14) różnych roztworów. Mieszając trochę soku z kapusty i roztworu, mieszanina zaczyna przybierać różne kolory, w zależności od jej kwaśnego lub zasadowego charakteru, zgodnie z poniższą skalą.
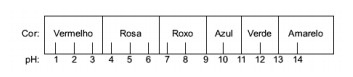
Niektóre rozwiązania zostały przetestowane z tym wskaźnikiem, uzyskując następujące wyniki:
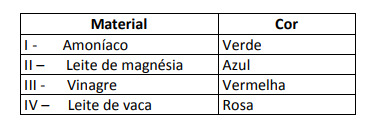
Zgodnie z tymi wynikami rozwiązania I, II, III i IV mają odpowiednio następujący charakter:
A) kwaśny / zasadowy / zasadowy / kwaśny.
B) kwas/zasada/kwas/zasada.
C) zasadowy / kwaśny / zasadowy / kwaśny.
D) kwas / kwas / zasada / zasada.
E) Zasadowy / Zasadowy / Kwasowy / Kwasowy.
Rozkład
Alternatywa E. Aby określić, czy substancja ma charakter kwasowy, zasadowy czy nawet obojętny, przeprowadza się analizę barw uzyskanych w teście w odniesieniu do danych z danej skali. Wiedząc, że roztwory o pH = 7 są obojętne, pH > 7 są zasadowe, a przy pH < 7 są kwaśne, dochodzimy do wniosek, że amoniak i mleko magnezowe są substancjami podstawowymi, a ocet i mleko krowie są kwasy.
Pytanie 2 - (PUC-Camp) Jeśli chodzi o substancje zwane kwasami, uczeń zauważył następujące cechy:
ja - mam moc korozyjną;
II - są zdolne do neutralizacji zasad;
III - składają się z dwóch pierwiastków chemicznych;
IV - tworzą wodne roztwory przewodzące prąd elektryczny.
Popełniał błędy TYLKO w
A) I i II
B) I i III
C) I i IV
D) II i III
E) III i IV
Rozkład
Alternatywa B. Nie wszystkie kwasy są żrące, tylko najsilniejsze, a kwasy mogą składać się z dwóch lub więcej atomów.
przez Laysę Bernardes
Nauczyciel chemii
