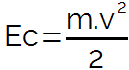Bateria to urządzenie, w którym prąd elektryczny wytwarzany jest z energii chemicznej pochodzącej z reakcja oksydoredukcyjna, to znaczy jeden gatunek reagenta traci elektrony (utlenianie), podczas gdy inny gatunek zyskuje elektrony (redukcja).
Zobacz reprezentacje reakcji utleniania i redukcji zachodzących w dowolnym stosie:
Utlenianie: X → i + X+
Gatunek X traci elektron i zamienia się w kation.
Zmniejszenie: Tak- + i → Y
anion Y- zyskuje elektron i przekształca się w neutralny rodzaj Y.
Podstawowe elementy stosu
Podstawowymi składnikami stosu są:
Anoda: elektroda ujemna, w której zachodzi reakcja utleniania, czyli utrata elektronów;
Katoda: elektroda dodatnia, w której zachodzi reakcja redukcji, czyli wzmocnienie elektronów;
Roztwór elektrolityczny (mostek solny) lub materiał przewodzący (taki jak sztabka grafitowa): to sposób, w jaki elektrony oddane przez anodę docierają do katody.
Podstawy działania baterii
Na funkcjonowanie stosu składają się następujące zdarzenia:
Pierwsza zasada: Utlenianie anodowe
Metal w anodzie, ponieważ ma większą skłonność do utraty elektronów, staje się kationem, co zaobserwowaliśmy w poniższym równaniu:
Zn → Zn2+ + 2 i
Druga zasada: redukcja katodowa
Kationy, które są częścią materiału obecnego w katodzie (jako przykład posłużymy miedź), przy odbiorze elektrony z anody zamieniają się w metaliczną miedź, jak widać w równaniu poniżej:
Tyłek2+ + 2e → Cu
pierwsze stosy
a) Bateria Alessandro Volty
Tył stosu Alessandro (pierwszy stos w historii), zmontowany w 1800 roku, został utworzony przez wstawione metalowe krążki, jak na poniższym obrazku:

Montaż podobny do Powrót Alessandro do twojego stosu
Krążki były przeplatane, ponieważ miały inny skład. Jedna była wykonana z metalicznego cynku, a druga z miedzi, zawsze oddzielona watą nasączoną solanką (roztwór utworzony przez wodę i sól).
Teraz nie przestawaj... Po reklamie jest więcej ;)
B) stos Daniella
Stos Daniella, zmontowany w 1836 roku, składał się z dwóch półogniw połączonych przewodem przewodzącym i mostkiem solnym.
Półogniwo 1: to była anoda, czyli ujemny biegun akumulatora.
Składał się z płyty cynkowej, a część tej płyty była zanurzona w roztworze utworzonym przez wodę i siarczan cynku (ZnSO4).
Połowa komórki 2: była to katoda, czyli dodatni biegun akumulatora.
Składał się z miedzianej płytki, a część tej płytki zanurzona była w roztworze utworzonym przez wodę i siarczan miedzi (CuSO4).
Most solny
Rurka w kształcie litery U, która zawierała roztwór utworzony przez wodę i chlorek potasu (KCl), która łączyła dwie półogniwa (cynk i miedź) i miała na obu końcach watę szklaną.
baterie obecnie
Obecnie istnieje kilka modeli stosów, ale ogólnie wyglądają one tak:
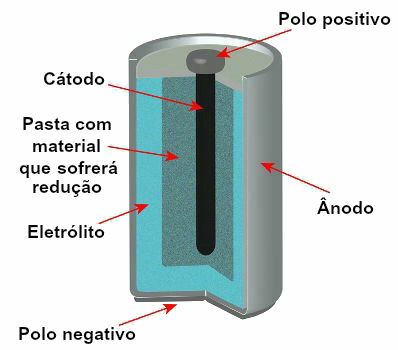
Schemat przedstawiający model bieżącego stosu
Najczęściej używane modele to tak zwana bateria Leclanché i bateria alkaliczna, które mają następujące różnice:
) Stos Leclanche
Posiada anodę utworzoną z metalicznego cynku;
Posiada katodę utworzoną przez pastę z chlorkiem amonu, wodą, skrobią i dwutlenkiem manganu;
Posiada pręt grafitowy, który służy jako przewodnik dla elektronów wychodzących z katody w kierunku anody.
B) Bateria alkaliczna
Posiada anodę utworzoną z metalicznego cynku lub kadmu;
Posiada katodę utworzoną z tlenku rtęci, tlenku niklu i jodu;
Musi mieć zmieszaną bazę w materiale tworzącym katodę.
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Co to jest bateria?”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm. Dostęp 27 czerwca 2021 r.