Idee dotyczące budowy materii (atomu) pojawiły się w starożytnej Grecji, około 450 rpne. a., głównie z Democrito i Leucipo. Jednak atom faktycznie uzyskał naukowy charakter dopiero po tzw Teoria atomowa Daltona.
TEN Teoria atomowa Daltona był fundamentalny dla rozwoju wiedzy o atomie, ponieważ służył jako podstawa dla innych naukowców do poznania atomu i jego cech.
Kto był John Dalton?
John Dalton, chemik z wykształcenia, urodził się w Kumbrii w Anglii w 1766 roku i zmarł w Manchesterze w 1844 roku. Od najmłodszych lat jego życie było przeznaczone na badania naukowe i nauczanie do tego stopnia, że nauczał lub przyczyniał się do rozwoju różnych dziedzin wiedzy.
Jego największym dziedzictwem jako naukowca było jednak opracowanie pierwszej teorii atomowej. To dzięki kilku eksperymentom związanym z mieszaniną gazów i znajomości prac zaproponowanych przez Lavoisiera, w 1808 roku pojawiła się teoria atomowa Daltona.
Postulaty teorii atomowej Daltona
Teoria atomowa Daltona opierała się na eksperymentach, ale żaden z tych eksperymentów nie mógł wyraźnie ujawnić atomu. Dlatego Dalton nazwał atom najmniejszą częścią materii.
Teoria Daltona przedstawia znacznie więcej postulatów niż dowodów. Zobacz niektóre z nich:
Atomy są masywne i kuliste (podobne do kuli bilardowej);
Atomy są niepodzielne;
Atomy są niezniszczalne;
Jeden pierwiastek chemiczny jest to zbiór atomów o tych samych właściwościach (wielkość i masa);
Atomy różnych pierwiastków chemicznych mają różne właściwości;
Do ich rozróżnienia można użyć względnej wagi dwóch atomów;
Związek chemiczny jest tworzony przez tę samą kombinację różnych typów atomów;
Różne substancje chemiczne powstają przez łączenie różnych atomów.
Reprezentacje modelu atomowego Daltona
Dalton nazwał swój model atomowy kulą bilardową i dlatego zaczął przedstawiać atomy pierwiastków znanych w jego czasach za pomocą symboli sferycznych.
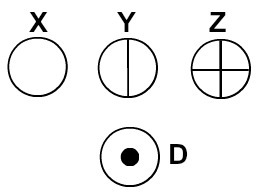
Atomy reprezentowane zgodnie z teorią atomową Daltona
Każda reprezentacja atomowa, która ma określony szczegół, wskazuje na inny pierwiastek chemiczny. Dydaktycznie książki i ćwiczenia na poziomie podstawowym i średnim przedstawiają atomy tylko za pomocą kulek o różnych kolorach.
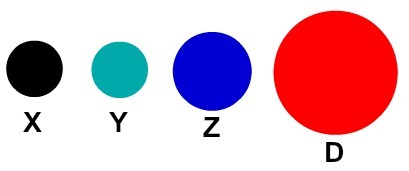
Dydaktyczna reprezentacja atomów
Wkład teorii atomowej Daltona
Zrozumienie Prawo zachowania mszy Lavoisiera
Francuski chemik Lavoisier twierdził w 1785 roku, że „w reakcji chemicznej masa jest zachowana, ponieważ nie ma ani tworzenia, ani niszczenia atomów” ”. Udowodniła to teoria atomowa Daltona, gdyż jeden z jego postulatów głosi, że atom jest niezniszczalny.
Dlatego jeśli spalamy węgiel (C) w obecności gazowego tlenu (O2), będziemy mieli reakcję chemiczną między jednym atomem węgla a dwoma atomami tlenu. W wyniku tej reakcji powstanie dwutlenek węgla (CO2), który ma dokładnie te same atomy, które tworzyły substancje przed reakcją.
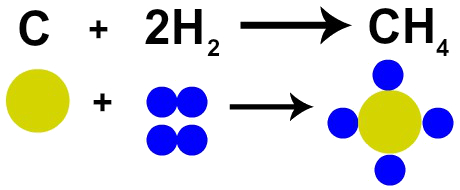
Reprezentacja prawa Lavoisiera przez model atomowy Daltona
Zrozumienie proste substancje
Używając model atomowy Daltona, możemy zrozumieć prostą substancję, to znaczy taką, która ma atomy o tej samej charakterystyce tworzące cząsteczkę. Dlatego mamy atomy należące do tego samego pierwiastka chemicznego.
W istocie F2, na przykład mamy dwa atomy fluoru, więc musimy użyć dwóch typów równych atomów w reprezentacji zgodnie z teorią atomową Daltona.

Prosta reprezentacja substancji według Atomowy model Daltona
Zrozumienie substancje złożone
W substancji złożonej mamy atomy o różnej charakterystyce tworzące cząsteczkę. W związku z tym mamy różne pierwiastki chemiczne tworzące substancję.
Substancja H2Na przykład O ma trzy atomy: dwa wodór i jeden tlen. Zobacz jego reprezentację zgodnie z atomowym modelem Daltona:
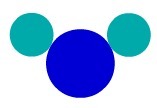
Reprezentacja substancji złożonej na skórzeAtomowy model Daltona
Zrozumienie mieszanek
Zrozumienie mieszaniny (połączenia dwóch lub więcej różnych substancji) poprzez teorię atomową Daltona jest proste: wystarczy umieścić dwie różne cząsteczki w tym samym pojemniku.

Reprezentacja drugiej mieszaniny Atomowy model Daltona
Inne wkłady naukowe Johna Daltona
wprowadził pojęcie masa atomowa;
Sformułowano prawo ciśnień cząstkowych gazów (Prawo Daltona);
Odkryto wadę wzroku zwaną ślepota barw;
Badał zachowanie par i gazów w różnych temperaturach;
Odkrył, że wszystkie gazy rozszerzają się (starają się zająć określone miejsce) w przestrzeni w ten sam sposób.
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm

