TEN pochodzenie Układ okresowy pierwiastków nastąpiło na początku XIX wieku, około 1829 roku, kiedy ówcześni chemicy postanowili zaproponować sposoby organizowania pierwiastki chemiczne znane do tej pory.
Na początku XIX wieku chemicy posiadali wiedzę o kilku cechach (gęstość, masa atomowa, reaktywność, temperatura topnienia, temperatura wrzenia, stan skupienia) trzydziestu pierwiastków chemicznych. Ta wiedza posłużyła jako punkt wyjścia dla pochodzenie układu okresowego pierwiastków.
W ciągu 200 lat kilku chemików próbowało zaproponować sposoby organizowania pierwiastków chemicznych, czyli Układ okresowy pierwiastków, który znamy dzisiaj, miał w rzeczywistości różne pochodzenie, ponieważ na przestrzeni dziejów było wiele prób wykonywane.
Mapa myśli: pochodzenie układu okresowego pierwiastków
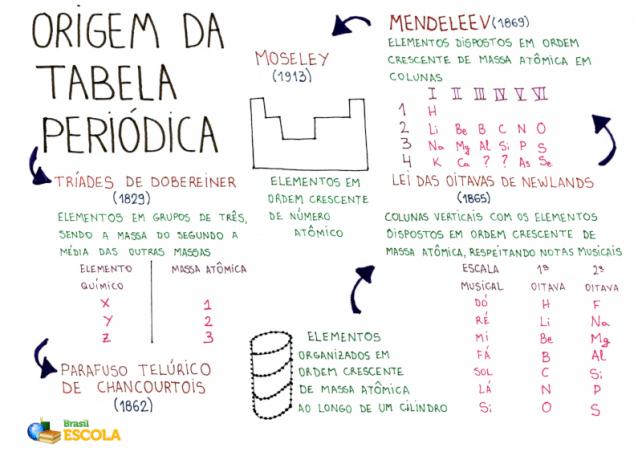
*Aby pobrać tę mapę myśli, Kliknij tutaj!
Oto niektórzy chemicy, którzy celowali w próbach uporządkowania elementów w tabeli.
Triady Dobereinera

Ilustracja Johanna Wolfganga Dobereinera *
W roku 1829 niemiecki chemik Johann Wolfgang Dobereiner zorganizował pierwszy w historii układ okresowy pierwiastków. Zawierał trzydzieści znanych do tej pory pierwiastków chemicznych i został przez niego nazwany triadami Dobereinera.
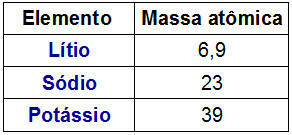
TEN Układ okresowy Dobereinera nazwano ją triadą, ponieważ elementy były zorganizowane w grupy po 3. Każda grupa miała pierwiastki o podobnych właściwościach chemicznych.
Reprezentacja triady Dobereinera
Ciekawostką dotyczącą triad Dobereinera jest to, że masa atomowa centralnego elementu triady był dokładnie wynikiem średniej arytmetycznej między masami atomowymi pozostałych dwóch elementów triady.

Telluric śruba Alexandre de Chancourtois
W roku 1862 francuski geolog i mineralog Alexandre de Chancourtois postanowił zaproponować organizację znanych wówczas pierwiastków chemicznych, aby ułatwić ich zastosowanie w mineralogii. TEN Stół Chancourtois nazywano to śrubą telluryczną.

Reprezentacja śruby tellurycznej Chancourtois
Chancourtois rozmieścił pierwiastki chemiczne (ciemne plamy na obrazie) w porządku rosnącym masy atomowej wzdłuż spiralnego pasma istniejącego w cylindrze. Dzięki tej organizacji Chancourtois zaobserwował, że pierwiastki umieszczone na tej samej linii pionowej mają podobne właściwości chemiczne.
Prawo Oktaw
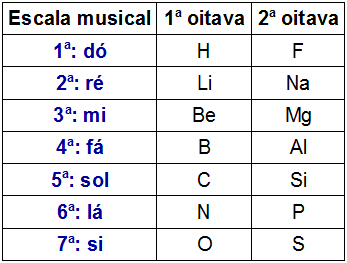
Prawo oktaw to nazwa zaproponowana przez angielskiego chemika J.A.R. Nowe ziemie, w roku 1865 do Układu Okresowego. Ponieważ Newlands jest także muzykiem, nastawił stół zgodnie z nutami (do, there, re, mi, fa, sol, there, si).
Newlands zorganizował 61 znanych wówczas pierwiastków chemicznych w porządku rosnącym według masy atomowej i umieścił je w pionowych kolumnach. Każda z pionowych kolumn miała siedem elementów.
Dwuoktawowa reprezentacja Newlands
Newlands zaobserwował, że pierwiastki chemiczne obecne w tej samej poziomej linii w różnych oktawach mają podobne właściwości chemiczne. Tak więc pierwszy element oktawy miał podobne właściwości do pierwszego elementu drugiej oktawy i tak dalej.
Układ okresowy Mendelejewa

Ilustracja chemika Mendelejewa **
Mendelejew, podczas pracy z pierwiastkami chemicznymi miał zwyczaj zapisywania właściwości każdego z nich na kartach. W pewnym momencie, w roku 1869, postanowił umieścić te żetony w porządku rosnącym według masy atomowej.
Zaraz po ułożeniu pierwiastków w kolejności rosnącej masy atomowej Mendelejew zachował wzór, ale umieścił elementy w kolumnach poziomych i pionowych, z poszanowaniem cech i podobieństw elementy.
Układ okresowy Moseleya
W roku 1913 angielski chemik HenzMoseley, w oparciu o tablicę zaproponowaną przez Mendelejewa, ułożył układ okresowy pierwiastków w znane nam dzisiaj wzory.
W przeciwieństwie do Mendelejewa, Moseley ułożył elementy w kolejności rosnącej Liczba atomowa, utrzymywał organizację w kolumnach poziomych i pionowych, ale umieszczał elementy o tych samych właściwościach chemicznych w tych samych kolumnach pionowych.
aktualny układ okresowy
Po 1913 r. Układ okresowy pierwiastków zaproponowany przez Moseleya nie uległ większym zmianom, w rzeczywistości przeszedł pewne aktualizacje, ponieważ odkryto pewne pierwiastki chemiczne.
Porównując ją z obecną tabelą, tabela Moseleya nie pokazała np. pierwiastków chemicznych o liczbach atomowych między 110 a 118. Ponadto szereg aktynowców znajdował się powyżej szeregu lantanowców.
TEN Ostatnia aktualizacja przeprowadzona w układzie okresowym miała miejsce w 2016 roku, kiedy to pierwiastki 113, 115, 117 i 118 oficjalnie weszły w jego skład.
* Kredyt obrazu: Yangchao/ migawki. Inc
** Kredyt obrazu: Olga Popowa/ migawki. Inc
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/origem-tabela-periodica.htm


