Elektroniczna dystrybucja elektronów atomu w stanie neutralnym lub podstawowym jest powszechnie wykonywana za pomocą Schemat Paulinga, pokazane poniżej:
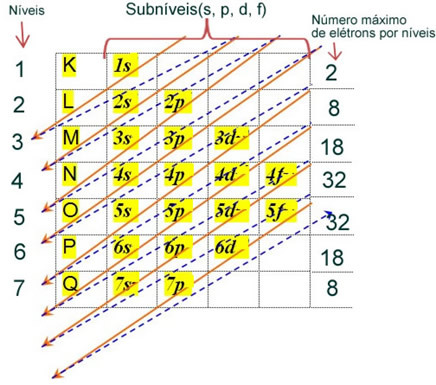
Szczegółowe zasady tej dystrybucji można znaleźć w dwóch następujących tekstach na naszej stronie internetowej: „Elektroniczna dystrybucja elektronów" i "Zasady dystrybucji elektronicznej”.
Elektroniczna dystrybucja jonów działa początkowo w taki sam sposób, jak w przypadku atomów w stanie neutralnym; z tylko jedną różnicą. Ponieważ jon jest atomem, który zyskał lub stracił elektrony, musimy wziąć to pod uwagę i wykonać następujące czynności:

Ważną obserwacją jest: zmiana dokonywana jest na najbardziej zewnętrznym podpoziomie, a nie na najbardziej energetycznym.
jeśli jon jest kation, musimy usuń elektrony że przegrał. Spójrzmy na przykład:
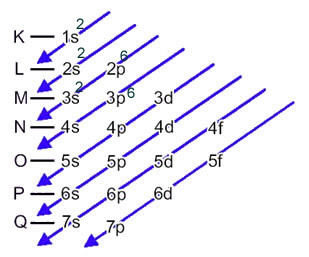
Atom żelaza (liczba atomowa = 26) ma następujący rozkład elektronowy w podpoziomach w porządku energetycznym: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Jeśli chodzi o warstwy elektroniczne, mamy: K =2; L = 8; M = 14; N = 2.
Rozkład ten pokazano na poniższym diagramie Paulinga:
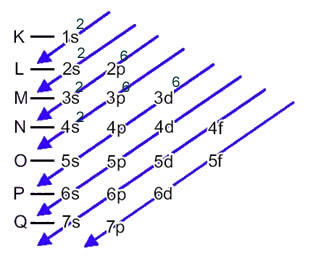
Gdy atom żelaza traci 2 elektrony, zamienia się w kation Fe.2+. Tak więc, robiąc Twoją elektroniczną dystrybucję, musimy usuń 2 elektrony z ostatniej powłoki(N) a nie z najbardziej energetycznego podpoziomu, jak pokazano niżej:
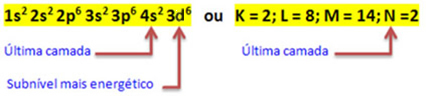
Tak więc elektroniczna dystrybucja kationu Fe2+ jest dany przez:
1s2 2s2 2p6 3s2 3p6 3d6 lub K = 2; L = 8; M = 14
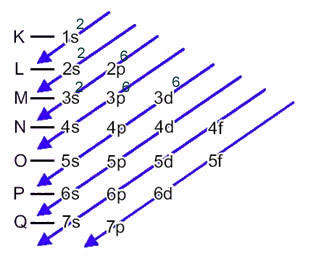
Teraz, jeśli musimy przeprowadzić elektroniczną dystrybucję anion, musimy dodaj otrzymane elektrony.Zobacz, jak to się robi w następującym przykładzie:
Anion siarki (16s2-) powstaje z atomu siarki (16S) przez wzmocnienie 2 elektronów, jak wskazuje ładunek 2-. Jego dystrybucja elektroniczna stanu podstawowego jest określona przez:
1s2 2s2 2p6 3s2 3p4 lub K = 2; L = 8; M = 6
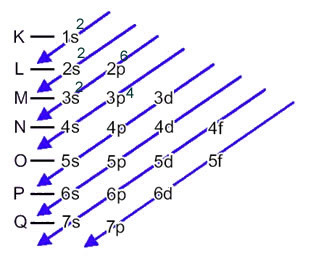
W tym przypadku ostatni podpoziom jest taki sam jak podpoziom energetyczny, 3p. Dodajemy więc do tego dwa elektrony anionu siarki:
1s2 2s2 2p6 3s2 3p6 lub K = 2; L = 8; M = 8
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm

