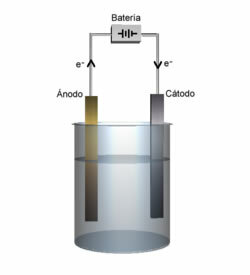
Ogniwa lub ogniwa elektrochemiczne i baterie to urządzenia, w których energia chemiczna jest spontanicznie przekształcana w energię elektryczną.Ogniwo składa się z zaledwie dwóch elektrod i elektrolitu, natomiast bateria to zestaw akumulatorów połączonych szeregowo lub równolegle.
W baterie galwaniczne są urządzeniami jednorazowymi, ponieważ gdy reakcja utleniania-redukcji zachodząca w nich ustaje, należy je odrzucić.
Dla każdego sprzętu wskazany jest typ baterii, a wśród obecnie stosowanych baterii podstawowych główne to: Ogniwa suche Leclanché (zwykłe baterie lub ogniwa kwasowe), baterie alkaliczne i baterie litowe/dwutlenek manganu.
Zobacz, co je wyróżnia i do jakiego sprzętu są odpowiednie:
- Suche komórki Leclanché:
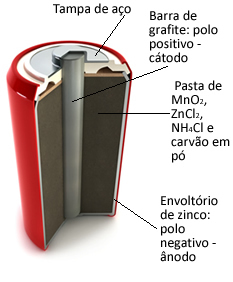
Te stosy są zasadniczo utworzone przez powłokę cynkową, oddzieloną porowatym papierem i centralnym prętem grafitowym otoczonym dwutlenkiem manganu (MnO2), sproszkowany węgiel drzewny (C) i mokra pasta zawierająca chlorek amonu (NH4Cl), chlorek cynku (ZnCl2) i wody (H2O).
O cynk
działa jak anoda, tracąc elektrony; to jest grafit działa jak katoda, przewodzące elektrony do dwutlenku manganu:Połowa reakcji anody: Zn (y) → Zn2+(tutaj) + 2 i-
Półreakcja katodowa: 2 MnO2(aq) + 2 NH41+(tutaj) + 2e- → 1 mln2O3(y) + 2NH3(g) + 1 godzina2O(1)
Reakcja globalna: Zn (y) + 2 MnO2(aq) + 2 NH41+(tutaj) → Zn2+(tutaj) + 1 mln2O3(s) + 2NH3(g)
Ten typ baterii nadaje się do urządzeń wymagających lekkiego i ciągłego rozładowania, takich jak pilot, zegar ścienny, przenośne radio i zabawki.
Więcej informacji na temat pochodzenia, funkcjonowania, trwałości, ddp, zagrożeń i środków ostrożności, które należy podjąć w przypadku tych baterii, można znaleźć w tekście „Suchy stos Leclanché”.
Teraz nie przestawaj... Po reklamie jest więcej ;)
- Baterie alkaliczne:
Jego działanie jest bardzo podobne do działania suchych ogniw Leclanché, jednak jedyną różnicą jest to, że zamiast chlorku amonu (który jest solą kwasową), dodaje się mocną zasadę, głównie wodorotlenek sodu (NaOH) lub wodorotlenek potasu (KOH).
Reakcja połówkowa anody: Zn + 2 OH → ZnO + H2O + 2e-
Półreakcja katodowa: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Ogólna reakcja: Zn +2 MnO2→ ZnO + Mn 2O3

Baterie alkaliczne są korzystniejsze od kwasowych w tym sensie, że mają większą trwałość, w zwykle zapewniają 50-100% więcej energii niż zwykła bateria o tym samym rozmiarze, a ponadto istnieje mniejsze niebezpieczeństwo przecieki.
Wskazane są głównie do urządzeń wymagających szybkiego i bardziej intensywnego pobierania, takich jak radia, przenośne odtwarzacze CD/DVD i MP3, latarki, aparaty cyfrowe itp.
Przeczytaj także tekst Baterie alkaliczne.
- Baterie litowo-dwutlenek manganu:
Baterie te są lekkie i generują duże napięcie (około 3,4 V), dlatego często wykorzystywane są w drobnym sprzęcie, takim jak zegarki czy kalkulatory. W przeciwieństwie do poprzednich przypadków, jego formatem jest waluta, jak pokazano na poniższym obrazku:

Anoda to lit, katoda to dwutlenek manganu, a elektrolit to roztwór soli:
Reakcja połówkowa anody: czytać →czytać+ + i−
Półreakcja katodowa: MnO2 + przeczytaj+ + i−→MnO2(li)
Ogólna reakcja: Li + MnO2 → MnO2(li)
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Najczęstsze typy ogniw i baterii podstawowych”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Dostęp 27 czerwca 2021 r.