Istnieje dziedzina nauki, która bada szybkość reakcji chemicznych i czynniki, które na nią wpływają, nazywa się kinetyką chemiczną. Reakcje chemiczne można zdefiniować jako zbiór zjawisk, w których dwie lub więcej substancji reaguje ze sobą, dając początek różnym związkom. Równanie chemiczne jest graficzną reprezentacją reakcji chemicznej, w której reagenty pojawiają się w pierwszym elemencie, a produkty w drugim.
A + B  C + D
C + D
Odczynniki Produkty
Wiedza i badanie reakcji, oprócz tego, że są bardzo ważne pod względem przemysłowym, są również związane z naszym codziennym życiem.
Szybkość reakcji określa, jak szybko zużywane są reagenty lub jak szybko powstają produkty. Palenie świecy i tworzenie się rdzy to przykłady powolnych reakcji. W dynamicie rozkład nitrogliceryny jest szybką reakcją.
Prędkości reakcji chemicznych są określane przez prawa empiryczne, zwane prawami prędkość, wyprowadzona z wpływu stężenia reagentów i produktów na prędkość reakcja.
Reakcje chemiczne zachodzą z różnymi prędkościami i można je zmieniać, ponieważ oprócz stężenie reagentów i produktów, szybkość reakcji zależy również od innych czynników lubić:
Stężenie odczynnika: im wyższe stężenie reagentów, tym szybsza reakcja. Aby zaszła reakcja między dwiema lub większą liczbą substancji, konieczne jest zderzenie cząsteczek, tak aby nastąpiło zerwanie wiązań, aw konsekwencji utworzenie nowych. Liczba zderzeń będzie zależeć od stężeń A i B. Zobacz zdjęcie:
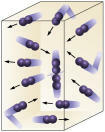
Cząsteczki zderzają się częściej, jeśli
zwiększamy liczbę reagujących cząsteczek.
Łatwo zauważyć, że ze względu na wyższe stężenie nastąpi wzrost zderzeń między cząsteczkami.
powierzchnia styku: wzrost powierzchni styku zwiększa szybkość reakcji. Przykładem jest sytuacja, gdy rozpuszczamy zmiażdżoną tabletkę sonrisalową i rozpuszcza się ona szybciej niż gdyby był cały, dzieje się tak, ponieważ zwiększamy powierzchnię kontaktu, która reaguje z Woda.
Nacisk: gdy zwiększasz ciśnienie w układzie gazowym, zwiększa się szybkość reakcji.
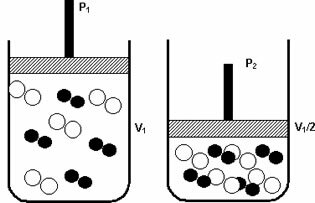
Wzrost ciśnienia z P1 do P2 zmniejszył objętość z V1 do V1/2, przyspieszając reakcję na skutek zbliżania się cząsteczek.
Powyższy rysunek jest przykładem, ponieważ wraz ze spadkiem objętości w drugim pojemniku nastąpi wzrost ciśnienie intensyfikujące zderzenia cząsteczek i w konsekwencji wzrost prędkości reakcja.
Temperatura: gdy temperatura układu wzrasta, następuje również wzrost szybkości reakcji. Zwiększenie temperatury oznacza zwiększenie energii kinetycznej cząsteczek. Na co dzień obserwujemy ten czynnik podczas gotowania i zwiększamy płomień pieca, aby żywność szybciej osiągnęła stopień ugotowania.
Katalizatory: Katalizatory to substancje, które przyspieszają mechanizm bez ulegania trwałym zmianom, czyli podczas reakcji nie są zużywane. Katalizatory pozwalają reakcji obrać alternatywną ścieżkę, która wymaga mniejszej energii aktywacji, co powoduje szybszy przebieg reakcji. Należy pamiętać, że katalizator przyspiesza reakcję, ale nie zwiększa wydajności, to znaczy wytwarza taką samą ilość produktu, ale w krótszym czasie.
Liria Alves
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm
