Atom to nazwa nadana kształtownikowi materii (wszystko, co zajmuje przestrzeń i ma masę). Nazwę tę zaproponowali greccy filozofowie Demokryt i Leucippus. Pierwiastki chemiczne, cząsteczki, substancje a materiały organiczne lub nieorganiczne są tworzone przez atomy.
W swojej budowie atom ma cząstki (protony, neutrony i elektrony), nie będące najmniejszą częścią materii. Nadal, Twoja wizualizacja nie jest możliwa. To, co wiadomo o atomie, wiąże się z naukowo udowodnionymi aspektami fizycznymi, chemicznymi i matematycznymi.
Ewolucja wiedzy o atomie spowodowała rozwój i udoskonalenie kilku technologii.
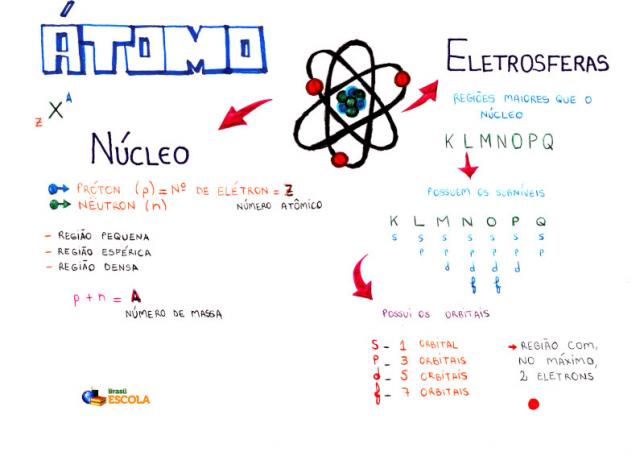
Podstawowy skład atomu
Rdzeń: gęstszy obszar atomu i zawiera protony i neutrony;
Poziomy energii: regiony otaczające jądro i mieszczące podpoziomy, orbitale i elektrony. Istnieje siedem poziomów energii, które są reprezentowane przez litery K, L, M, N, O, P i Q;
Podpoziomy energetyczne: to regiony, w których znajdują się orbitale. Są obecne na wszystkich poziomach i są reprezentowane przez litery (s, p, d f). Jego ilość zależy od każdego poziomu: K (ma s podpoziomów), L (ma s i p podpoziomów), M (ma s, p i d podpoziomów), N (ma podpoziomy s, p, d i f), O (ma podpoziomy s, p, d i f), P (ma podpoziomy s, p i d) oraz Q (ma podpoziomy s i P);
Orbitale atomowe: regiony z największym prawdopodobieństwem znalezienia elektronu. Każdy podpoziom ma inną liczbę orbitali: s (jeden orbital), p (trzy orbitale), d (pięć orbitali) if (siedem orbitali);
protony: cząstki dodatnie (reprezentowane przez p);
elektrony: cząstki ujemne, które również zachowują się falowo (reprezentowane przez e);
neutrony: nienaładowane cząstki, które zmniejszają odpychanie między protonami w jądrze (reprezentowane przez n).
Mapa myśli: Atom
* Aby pobrać mapę myśli w formacie PDF, Kliknij tutaj!
reprezentacja atomu
Najprostszym sposobem przedstawienia atomu jest użycie skrótu pierwiastka chemicznego, który tworzy. Na przykład akronim Se oznacza wszystkie atomy, które tworzą pierwiastek chemiczny selen.
Akronim reprezentujący atom może nadal zawierać dwie ważne informacje: liczbę atomową (reprezentowaną przez literę Z i zawsze po lewej stronie na dole akronimu atomu) i liczbę masową (reprezentowaną przez literę A, która może być umieszczona po lewej lub prawej stronie na górze akronimu atomu atom).
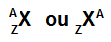
Akronim atomu o liczbie masowej i liczbie atomowej
Liczba atomowa (Z): wskazuje liczbę protonów obecnych w jądrze atomu i liczbę elektronów (e) obecnych na poziomach energetycznych.
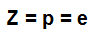
Wzór wskazujący reprezentatywność liczby atomowej
Numer masowy (A): wskazuje masę obecną w jądrze atomu, która wynika z sumy liczby protonów (p) i liczby neutronów (n).

Wzór wskazujący reprezentatywność liczby masowej
Podobieństwa atomowe
Atomy tego samego pierwiastka chemicznego lub różnych pierwiastków chemicznych można porównać pod względem liczby protonów, elektronów, neutronów i masy, klasyfikując w następujący sposób:
a) Izotopy
Są to atomy, które mają:
ta sama liczba atomowa;
taka sama liczba protonów;
inna liczba masowa;
różna liczba neutronów;
Przykład:
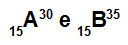
Atomy A i B są izotopami
Atomy A i B są izotopami, ponieważ:
Atom A ma 15 protonów, liczbę atomową równą 15, 15 elektronów, 15 neutronów i liczbę masową równą 30.
Atom B ma 15 protonów, liczbę atomową równą 15, 15 elektronów, 20 neutronów i liczbę masową równą 35.
b) Izobary
Są to atomy, które mają:
różne liczby atomowe;
różne liczby protonów;
różne liczby elektronów;
te same liczby masowe;
różne liczby neutronów.
Przykład:
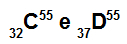
Atomy C i D to izobary
Atomy C i D są izobaryczne, ponieważ:
Atom C ma 32 protony, liczbę atomową równą 32, 32 elektrony, 23 neutrony i liczbę masową równą 55.
Atom D ma 37 protonów, liczbę atomową równą 37, 37 elektronów, 18 neutronów i liczbę masową równą 55.
c) Izotony
Są to atomy, które mają:
różne liczby atomowe;
różne liczby protonów;
różne liczby elektronów;
różne liczby masowe;
taka sama liczba neutronów.
Przykład:
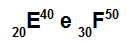
Atomy E i F są izotopami
Atomy E i F są izotopami, ponieważ:
Atom E ma 20 protonów, liczbę atomową równą 20, 20 elektronów, 20 neutronów i liczbę masową równą 40.
Atom F ma 30 protonów, liczbę atomową równą 30, 30 elektronów, 20 neutronów i liczbę masową równą 50.
d) Izoelektronika
Są to atomy, które mają:
taką samą liczbę elektronów.
UWAGA: Atomy izoelektroniczne mogą mieć również tę samą liczbę masową (izobary), tę samą liczbę neutronów (izotonów) lub tę samą liczbę protonów (izotopów).
Przykład:
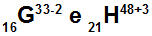
Atomy G i H są izoelektroniczne
Atomy G i H są izoelektroniczne, ponieważ:
Atom G ma 16 protonów, liczbę atomową równą 16, 18 elektronów (znak -2 wskazuje, że ma o dwa elektrony więcej niż liczba protonów), 17 neutronów i liczbę masową równą 33.
Atom H ma 21 protonów, liczbę atomową równą 21, 18 elektronów (znak +3 wskazuje, że ma o trzy elektrony mniej niż liczba protonów), 27 neutronów i liczbę masową równą 48.
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm
