TEN geometria kątowa jest jednym z kilku rodzajów geometria molekularna, który nadal może być liniowy, piramidalny, płaski trygonalny, czworościennyitp. Geometrię kątową można znaleźć tylko w cząsteczkach, które mają następujące cechy:
Trójatomowe, to znaczy mają tylko trzy atomy;
Mieć co najmniej trzy chmury elektronów w centralnym atomie.
Uwaga: chmura elektroniczna to wszystko wiązanie kowalencyjne (pojedyncze, podwójne, potrójne lub współrzędne) pomiędzy atomami i parami elektronów warstwa walencyjna którzy nie uczestniczą w rozmowie.
Zobacz kilka przykładów cząsteczek, które mają geometrię kątową:
Pierwszy przykład: woda (H2O)

konwencjonalna struktura wody
W strukturze wody mamy:
Trzy atomy: dwa wodory i jeden tlen;
Tlen jest centralnym atomem, ponieważ tworzy większą liczbę wiązań (dwa, ponieważ należy do rodziny VIA);
Dwa pojedyncze wiązania między tlenem a wodorami. Dzieje się tak dlatego, że każdy wodór może tworzyć tylko jedno wiązanie, a tlen dwa wiązania;
Cztery niewiążące elektrony w tlenie, ponieważ ma sześć elektronów w powłoce walencyjnej i wykorzystuje tylko dwa w wiązaniach.
Tak więc, jak w cząsteczce wody, w centralnym atomie znajdują się trzy atomy i cztery obłoki elektronowe (dwa pojedyncze wiązania i dwie niewiążące pary elektronów), geometria jest kanciasta.
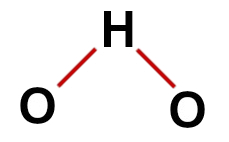
Prawidłowy wzór strukturalny wody
Uwaga: Ilekroć cząsteczka przedstawia te wzory, kąt utworzony między atomami wynosi około 109º 28'.
Drugi przykład: Dwutlenek siarki (SO2)

Konwencjonalna struktura dwutlenku siarki
W strukturze dwutlenku siarki mamy:
Trzy atomy: dwa tleny i jeden atom siarki;
Siarka jest centralnym atomem, ponieważ jest najmniejszym pierwiastkiem w cząsteczce, ponieważ wszystkie pierwiastki muszą tworzyć taką samą liczbę wiązań (dwa);
Podwójne wiązanie między siarką a jednym z tlenów. To dlatego, że oba wymagają dwóch połączeń;
Jeden koordynacyjne lub celownikowe wiązanie kowalencyjne, ponieważ siarka była stabilna po sparowaniu z innym tlenem, ale nadal istnieje atom tlenu, który potrzebuje dwóch elektronów;
Cztery niewiążące elektrony w tlenie. Dzieje się tak, ponieważ tlen ma sześć elektronów w powłoce walencyjnej i wykorzystuje tylko dwa w wiązaniach.
Tak więc, podobnie jak w cząsteczce dwutlenku siarki, w centralnym atomie znajdują się trzy atomy i cztery obłoki elektronowe (dwa pojedyncze wiązania i dwie pary niewiążących elektronów), geometria jest kanciasta.
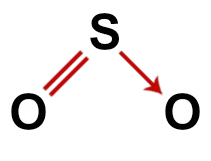
Prawidłowy wzór strukturalny dwutlenku siarki
Uwaga: Ilekroć cząsteczka ma te wzory, kąt utworzony między atomami wynosi około 120O.
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm
