aktywne izomery lub optycznie aktywne izomery (IOA) to cząsteczki określonej substancji chemicznej, które mogą przeprowadzać polaryzację i odchylenie plan lekki w prawo lub w lewo. Aby sprawdzić, czy substancja ma aktywne izomery, czy nie, wystarczy sprawdzić, czy w jej wzorze strukturalnym występuje asymetryczny węgiel:

Analizując łańcuch przedstawiony na powyższym obrazku, widzimy, że węgiel centralny ma cztery różne ligandy (OH, H, CH3 i Cl), co sprawia, że jest to węgiel asymetryczny, zwany także węglem chiralny. Tak więc, ilekroć łańcuch ma jeden lub więcej chiralnych węgli, będą aktywne izomery.
ty rodzaje aktywnych izomerów(IOA) oni są:
Praworęczny: Aktywny izomer optyczny, który zagina światło spolaryzowane w prawo;
Levogiro: Aktywny izomer optyczny, który zagina światło spolaryzowane w lewo.
Obserwacja: Obecność węgla asymetrycznego we wzorze strukturalnym wskazuje, że substancja musi mieć izomer lewoskrętny i izomer prawoskrętny. Nie od nas zależy, w którą stronę ugięło się światło, ponieważ obecność chiralnego węgla już to potwierdza. Zawsze połowa istniejących cząsteczek jest lewoskrętna, a druga połowa prawoskrętna.
Cząsteczki lewoskrętne i prawoskrętne dowolnej substancji organicznej zawsze mają te same właściwości fizyczne (punkt topnienie, temperatura wrzenia, gęstość, rozpuszczalność itp.), ale wykazują aktywność chemiczną (zachowanie w organizmie) wiele różnych. Przykładem jest adrenalina. W organizmie działa tylko cząsteczka adrenaliny, lewogyra, natomiast dextrogyra nie.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Zobacz teraz wzór strukturalny substancji butan-2-ol, aby sprawdzić, czy ma ona aktywne izomery:
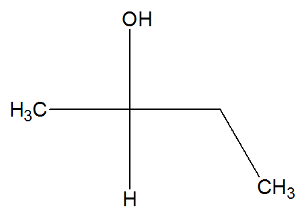
W strukturze butan-2-olu możemy zaobserwować, że węgiel 2 ma cztery różne segregatory (OH, H, CH3, CH2-CH3), więc jest to węgiel chiralny i przedstawia aktywny izomer prawoskrętny i inny lewoskrętny aktywny izomer.
Obliczanie aktywnych izomerów (IOA)
Holenderski chemik Jacobus Henricus van't Hoff opracował formułę, która pozwala obliczyć, ile aktywnych izomerów (IOA) może zawierać dana substancja. Popatrz:
IOA: 2Nie
n: to liczba chiralnych węgli we wzorze strukturalnym substancji.
Prześledź dwa przykłady zastosowania formuły Vant't Hoff:
Kwas 5-dichloro-2,3-dihydroksy-heksanodiowy

We wzorze strukturalnym związku występują trzy chiralne węgle lub asymetryczny, zatem:
IOA = 2Nie
IOA = 23
IOA = 8
2,3,4,5-tetrahydroksyheksanal

We wzorze strukturalnym związku są cztery chiralne węgle (Czerwone strzały) lub asymetryczny, zatem:
IOA = 2Nie
IOA = 24
IOA = 16
Obserwacja: Istnieje możliwość, że wzór strukturalny zawiera dwa asymetryczne węgle, które mają dokładnie takie same ligandy. Jeśli tak się stanie, w obliczeniach bierzemy pod uwagę tylko 1 dla wartości n, a nie 2. Zobacz przykład:
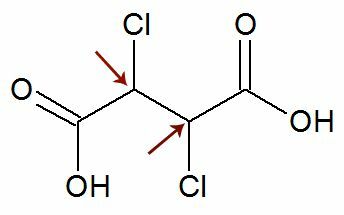
Lubić dwa chiralne węgle oni są równa się, bierzemy pod uwagę tylko jeden węgiel w obliczeniach:
IOA = 2Nie
IOA = 21
IOA = 2
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Aktywne izomery”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm. Dostęp 27 czerwca 2021 r.


