Reakcje sulfonowania w alkanach oni są reakcje podstawienia organicznego, realizowany w celu produkcji kwasy sulfonowe (związki organiczne posiadające grupę SO)3H przyłączony do atomu węgla lub łańcucha węglowego) i wody (H2O).
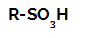
Wzór strukturalny kwasu sulfonowego
Do przeprowadzenia reakcji sulfonowania na alkany, musimy wymieszać alkan (związek utworzony przez łańcuch węglowy nasycony tylko atomami węgla i wodoru) i Kwas Siarkowy (H2TYLKO4) zatężony, poddany ogrzewaniu (∆).
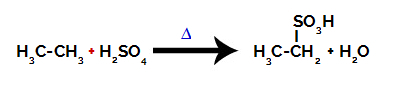
Równanie chemiczne przedstawiające sulfonowanie dwuwęglowego alkanu
Zasady reakcji sulfonowania w alkanach
Jak na przykład reakcja sulfonowania alkanów jest to reakcja substytucji, mamy w niej wymianę pomiędzy mniejszymi składnikami elektroujemność reagentów, to znaczy między alkanem a kwasem siarkowym. Alkany zawierają wodór, a kwas siarkowy grupę sulfonową.
Poniżej mamy krok po kroku mechanizm a reakcja sulfonowania w alkanach. Jako przykład użyjemy najprostszego alkanu, metanu (CH4):
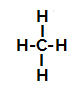
Wzór strukturalny metanu
Krok 1: Rozerwanie wiązania między hydroksylem (OH) i siarką (S) w kwasie siarkowym.
Każda grupa hydroksylowa obecna w kwasie siarkowym charakteryzuje się tym, że jest bardziej elektroujemna. Przy ogrzewaniu podczas reakcji występuje tendencja do zerwania wiązania między grupą hydroksylową a siarką:
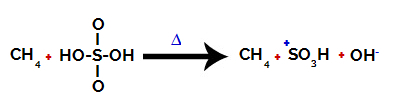
Zerwanie wiązania między siarką a hydroksylem
Jednak zerwanie wiązania wszystkich hydroksyli nie następuje z powodu przegrupowania elektronów w strukturze. Następnie otrzymuje się anion wodorotlenkowy (OH).-) i kation sulfonowy.
Drugi krok: Atak grup hydroksylowych na cząsteczkę alkanu.
Następnie grupa hydroksylowa (OH-) przeprowadza atak na alkan, powodując zerwanie wiązania między węglem a wodorem (które jest bardziej kruche ze względu na różnicę w elektroujemności między nimi).
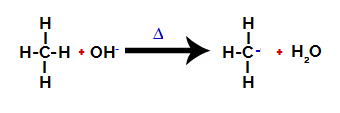
Zerwanie wiązania między węglem a wodorem w alkanie
Uwaga: Zerwanie wiązania między węglem a wodorem zawsze będzie następować najczęściej na węglu o mniejszej gęstości elektronowej lub ładunku. Im mniej wodorów ma węgiel lub im więcej grup jest do niego przyłączonych, tym mniejsza jest jego gęstość elektronowa. Więc mamy:
Węgiel trzeciorzędowy < Węgiel wtórny < Węgiel pierwotny
Po zerwaniu wiązania alkan staje się węglem z niedoborem elektronów (karbokacja). Grupa wodorotlenkowa (OH)-) oddziałuje z uwolnionym wodorem i tworzy cząsteczkę wody.
Trzeci krok: Atak utworzonego rodnika na grupę sulfonową.
Wreszcie grupa sulfonowa jest atakowana przez resztę alkanu, tworząc kwas sulfonowy.
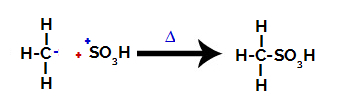
Struktury, które oddziałują i tworzą kwas sulfonowy
Przykłady równań reprezentujących reakcje sulfonowania w alkanach
Pierwszy przykład: Sulfonowanie propanu.
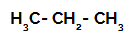
Wzór strukturalny propanu
Propan ma dwa węgle pierwotne i jeden węgiel wtórny, które mają różne ładunki, ponieważ są związane z różnymi ilościami wodoru. Ponieważ węgiel jest bardziej elektroujemny niż wodór, węgle te mają różne gęstości elektronowe.
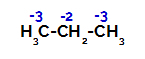
Rozkład ładunków na każdym atomie węgla propanu
Na węglach pierwotnych ładunek wynosi -3 (ponieważ jest związany z trzema wodorami), a na węglu wtórnym ładunek wynosi -2 (ponieważ jest związany z dwoma wodorami). W ten sposób nastąpi przerwanie wiązania między węglem a wodorem, czasem przy węglu 1 (jednej cząsteczki), czasem przy węglu 2 (innej cząsteczki).
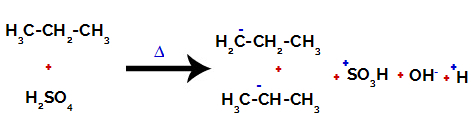
Zerwanie wiązania między węglem a wodorem na różnych węglach
Po zerwaniu wiązań, zarówno w kwasie siarkowym, jak i alkanie, powstaje produkty z zastąpieniem wodoru na węglu 1 grupą sulfonową, a to samo zachodzi na węglu 2.
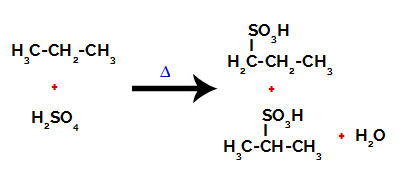
Produkty powstałe z sulfonowania propanu
Drugi przykład: Sulfonowanie 2-metylobutanu.

Wzór strukturalny 2-metylo-butanu
2-Metylobutan ma trzy węgle pierwszorzędowe, węgiel drugorzędowy i węgiel trzeciorzędowy, które mają różne ładunki, a co za tym idzie różne gęstości elektronowe, co widać w następującej strukturze:
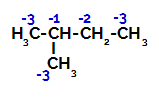
Rozkład ładunków elektronicznych w 2-metylo-butanie
Dlatego w 2-metylo-butanie istnieje kilka możliwości zerwania wiązania między węglem a wodorem, które mogą wystąpić na węglu 1 (cząsteczki), węglu 2 (innej cząsteczki), węglu 3 lub węglu 4. Warto jednak zauważyć, że zakłócenia na poziomie węgla 2 są bardziej powszechne.
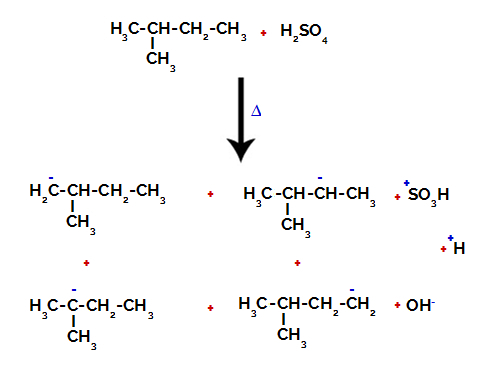
Zerwanie wiązania między węglem a wodorem na różnych węglach
Po zerwaniu wiązań, zarówno w kwasie siarkowym, jak i alkanie, powstanie produkty z zastąpieniem wodoru na węglu 1 grupą sulfonową i to samo dzieje się na węgiel 2.

Produkty powstałe z sulfonowania 2-metylo-butanu
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
