Istnieją trzy rodzaje alkadienów lub dienów, którymi są:
1-Skumulowane: Wiązania podwójne znajdują się na tym samym węglu i pojawiają się kolejno:
C ═ DO ═ C
│ │
2- Izolowane: Wiązania podwójne znajdują się na różnych węglach i są oddzielone co najmniej dwoma kolejnymi wiązaniami pojedynczymi:
│
C ═ C C ─ C ═ C
│ │ │ │ │
3- Koniugaty: Wiązania podwójne pojawiają się naprzemiennie, oddzielone pojedynczym wiązaniem:
C ═ C C ═ C
│ │ │ │
Przykładem ważnego sprzężonego dienu jest izopren, który jest podstawową jednostką grupy terpenów, klasy związków organicznych. bardzo ważne, niektóre przykłady produktów tworzonych przez izopreny to guma, beta-karoten (odpowiedzialny za pomarańczowy kolor marchew), witaminę A i oleje znajdujące się w skórkach owoców, nasionach, kwiatach, liściach, korzeniach, warzywach i drewnie, takie jak limonen i mircen.
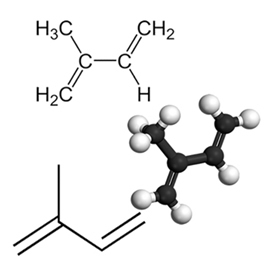
Do nagromadzone i izolowane dieny, zachodzą reakcje dodawania podobnie jak w przypadku alkenów, co możesz zrozumieć czytając tekst Reakcje dodawania. Jedyną różnicą jest to, że dieny ulegają tego typu podwójnej reakcji, ponieważ mają dwa podwójne wiązania, podczas gdy alkeny mają tylko jedno podwójne wiązanie.
Jednak w przypadku sprzężone dieny, reakcja addycji jest szczególna, ponieważ związki te mogą ulegać rezonansowi, więc addycja może odbywać się na dwa sposoby:
1- Dodatek 1.2:
Jest to uważane za normalne addycje, ponieważ addycja zachodzi na dwóch atomach węgla, które tworzą to samo podwójne wiązanie, to znaczy na węglach 1 i 2:
H2DO ═ CH─ CH ═ CH2 + HBr → H2C CH─ CH ═ CH2
│ │
HBr
Zobacz, że ten typ reakcji następuje po Reguła Markownikowa, wodór wiąże się z bardziej uwodornionym węglem (z przyłączonymi większą liczbą atomów wodoru).
Dodatek 1,2 przetwarzany jest w niskich temperaturach (-60°C).
2- Dodatek 1.4:
W tym przypadku reakcja przebiega w wysokich temperaturach. Należy podkreślić, że zawsze powstaje zarówno produkt dodawania 1,2, jak i dodawania 1,4, ale temperatura wskazuje, który będzie powstawał w większej ilości.
Poniżej znajduje się przykład dodawania typu 1.4:
H2DO ═ CH─ CH ═ CH2 + HBr → H2C CH ═ CH─CH2
│ │
HBr
Zwróć uwagę, że występuje następujące zjawisko, jeden ze wspólnych elektronów w wiązaniu pi każdego z podwójnych węgli są dzielone z podstawnikiem, a pozostałe tworzą nowe wiązanie podwójne między innymi atomami węgla:
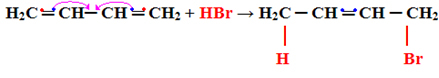
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/reacoes-adicao-dienos.htm

