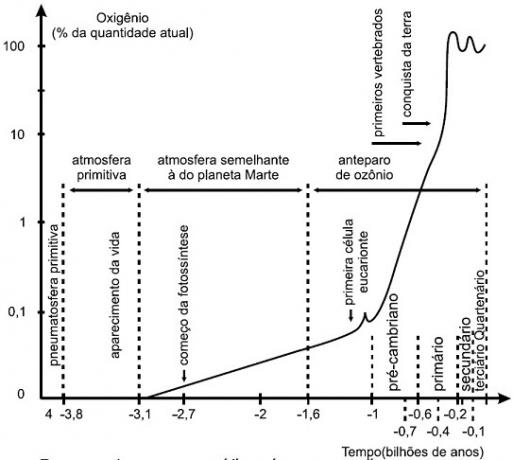
TEN hydroliza solna między mocnymi kwasami a zasadami występuje, gdy kation w soli nie wchodzi w interakcję z anionem w wodzie, a anion w soli nie wchodzi w interakcję z kationem w wodzie. Hydroliza między kationami i anionami soli i wody zachodzi tylko wtedy, gdy utworzony produkt jest słabym kwasem, słabą zasadą lub jednym i drugim. Zrozum krok po kroku hydrolizę soli między mocnymi kwasami i mocnymi zasadami:
a) Krok 1: jonizacja wody
Woda jest substancją, która ma zdolność cierpienia autojonizacja, czyli wytwarza kation hydroniowy (H+) i anion wodorotlenkowy (OH-) z jego struktury.
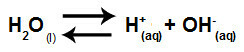
Równanie przedstawiające samojonizację wody
b) Krok 2: Dysocjacja z soli
Po dodaniu soli do wody przechodzi ona przez proces dysocjacji. Ponieważ sól jest związkiem jonowym, w wodzie jej kationy i aniony są uwalniane do środowiska, jak w poniższym równaniu:
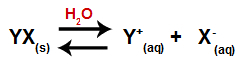
Równanie reprezentujące dysocjację dowolnej soli
c) Krok 3: Hydroliza solna mocnych kwasów i zasad
Dla mocnego kwasu: gdy anion soli połączy się z H+ wody do postaci HCl, HBr, HI lub innego kwasu, w którym odjęcie liczby tlenów przez liczbę wodorów jest równe lub większe niż 2, będziemy mieli
mocny kwas. Dlatego połączenie pomiędzy wymienionymi jonami nie występuje.Dla mocnego fundamentu: gdy kation soli należący do rodziny IA (metale alkaliczne) lub IIA (metale ziem alkalicznych inne niż magnez) jest połączony z OH- wody, utworzy mocny fundament. Dlatego połączenie pomiędzy wymienionymi jonami nie występuje.
Gdy jony soli nie oddziałują z jonami wody, mamy następujące równanie:
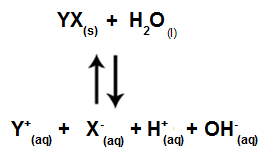
Równanie pokazujące wszystkie jony obecne w roztworze
Podsumowując, ponieważ jony soli nie oddziałują z jonami wody, jony soli nie powodują żadnych zmian w końcowym roztworze. W ten sposób możemy zapisać równanie hydrolizy soli między mocnymi kwasami i mocnymi zasadami za pomocą równania jonizacji wody.
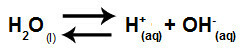
Równanie przedstawiające hydrolizę mocnych kwasów i zasad
d) Przykład hydrolizy soli między mocnymi kwasami i zasadami
Gdy dodamy sól chloran potasu do wody (KClO3), sól dysocjuje i uwalnia kation potasu (K+) i anion chloranowy (ClO3-) pośrodku.
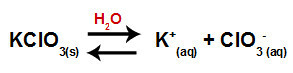
Równanie dysocjacji chloranu potasu potassium
Należy pamiętać, że woda ulega samojonizacji i dostarcza pożywce kationu hydroniowego (H+) i anion wodorotlenkowy (OH-). Musimy teraz ocenić interakcję między jonami soli i wody.
Kiedy H+ oddziałuje z ClO3-, tworzy kwas nadchlorowy (HclO3). Ponieważ odjęcie liczby tlenów od liczby jonizowalnych wodorów w kwasie nadchlorowym wynosi 2, jest to mocne. Dlatego interakcja między jonami nie występuje.
Kiedy kation K+ oddziałuje z anionem OH-, tworzymy mocną zasadę, ponieważ potas jest metalem alkalicznym. Dlatego interakcja między jonami nie występuje.
Równanie przedstawiające hydrolizę soli między mocnymi kwasami i zasadami z rozpuszczenia chloranu potasu w wodzie to:
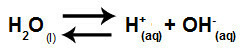
Równanie chemiczne hydrolizy chloranu potasu
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm