Amerykański chemik Gilbert N. Lewis (1875-1946) zaproponował zasadę oktetu, która mówi:
„Atomy różnych pierwiastków tworzą wiązania chemiczne, oddając, odbierając lub dzieląc elektrony, w celu uzyskania konfiguracji elektronowej gaz szlachetny, czyli z 8 elektronami w ostatniej powłoce (lub z 2 elektronami w przypadku atomów, które mają tylko jedną powłokę elektronową, jak to ma miejsce w przypadku wodór)."
W 1916 Lewis zasugerował, że aby zachować stabilność, dochodząc do oktetu lub duetu, elementów składających się na substancje molekularne wykonać udostępnianie par elektronów. Substancje te tworzą tylko atomy wodór, niemetale i półmetale, wszystko z skłonność do przyjmowania elektronów. Dlatego nie ma możliwości, aby którykolwiek z nich oddał jakikolwiek elektron (jak to ma miejsce w przypadku metali w wiązaniach jonowych), ale każdy musi otrzymać, więc dzielą się swoimi elektronami przez wiązanie kowalencyjne lub molekularny.
W ten sposób Gilbert Lewis zaproponował sposób reprezentowania wiązania kowalencyjnego lub molekularnego, które stało się znane jako
Wzór Lewisa. Nazywa się ją również formuła elektroniczna lub jeszcze, Formuła elektroniczna Lewisa, ponieważ jego główną cechą jest to, że pokazuje elektrony w powłoce walencyjnej każdego atomu i tworzenie par elektronowych.Każdy elektron jest reprezentowany przez kropkę., który otacza symbol odpowiedniego pierwiastka chemicznego. Wokół pierwiastka znajdują się tylko elektrony powłoki walencyjnej.
Jak pokazano w poniższej tabeli, aby poznać ilość elektronów w powłoce walencyjnej, wystarczy poznać rodzinę układów okresowych:

W formule Lewisa każda wspólna para elektronów reprezentuje wiązanie chemiczne (kowalencyjne), gdzie elektrony spotykają się w obszarze elektrosfery, który jest wspólny dla każdej pary połączonych atomów. Dlatego w przedstawieniu są umieszczone obok siebie.
Na przykład dowiedzmy się, jaki jest wzór Lewisa dla gazowego wodoru, którego wzór cząsteczkowy to: H2.
Każdy atom wodoru ma tylko jeden elektron w powłoce walencyjnej, ponieważ pierwiastek ten należy do pierwszej rodziny układu okresowego. Każdy musi otrzymać jeszcze jeden elektron, aby był stabilny, z dwoma elektronami w powłoce elektronowej K. Więc dzielą się swoimi elektronami i oboje dostają dwa. Popatrz:
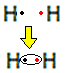
To jest wzór Lewisa dla cząsteczki wodoru.
Tlen ma sześć elektronów w swojej powłoce elektronowej, więc każdy musi otrzymać dwa dodatkowe elektrony, aby był stabilny, z ośmioma elektronami. Dlatego wzór Lewisa dla cząsteczki tlenu jest następujący:

Zobacz, że istnieją dwa łącza, ponieważ istnieją dwie wspólne pary.
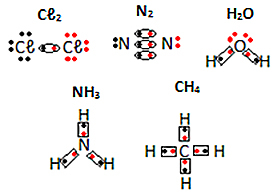
Zobacz inne przykłady wzorów elektronicznych substancji molekularnych poniżej:
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm
