TEN hybrydyzacja węgla typu sp sp dzieje się tak tylko wtedy, gdy tworzy dwa wiązania pi (π) i dwa wiązania sigma (σ). W tym przypadku są więc dwie możliwości: węgiel może tworzyć dwa podwójne wiązania lub pojedyncze i potrójne wiązanie, jak pokazano poniżej:
Tekst "hybrydyzacja typu sp3” pokazuje szczegółowo, jak przebiega hybrydyzacja węgla. Przypomnijmy: hybrydyzacja to „mieszanie” czystych orbitali atomowych, z których powstają hybrydowe orbitale atomowe równoważne sobie, ale różniące się od oryginalnych czystych orbitali. Tak więc dzieje się to na orbitalach węglowych, które pierwotnie były reprezentowane w ten sposób:
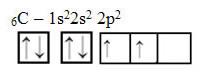
Jednak wraz z odbiorem energii elektron (reprezentowany przez strzałkę) z orbitalu 2s jest promowany na orbital 2p:
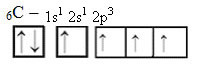
W ten sposób węgiel ma cztery niesparowane orbitale, mogąc tworzyć cztery wiązania kowalencyjne, a nie tylko dwa.
W przypadku hybrydyzacji typu sp wiemy, że dwa wiązania będą pi; te występują w czystych orbitalach „p”, podczas gdy pozostałe dwa orbitale, które są hybrydami sp, utworzą pozostałe wiązania sigma.
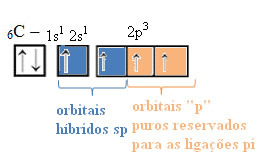
Przestrzenną reprezentację tej hybrydyzacji między orbitalem s i p, dającą początek hybrydowemu orbitalowi sp, można przedstawić w następujący sposób:
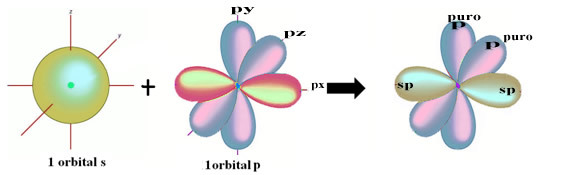
Na powyższym rysunku jest bardzo jasne, że istnieją dwa czyste orbitale, które tworzą wiązania pi.
Aby zrozumieć, jak to się dzieje, weźmy jako przykład cząsteczkę gazu cyjankowego (HCN), używaną w Stanach Zjednoczonych w komorach gazowych dla więźniów skazanych na karę śmierci. Jej wzór strukturalny wyraża się wzorem:
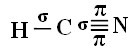
Jeśli chodzi o węgiel, jego orbitale atomowe zostały już pokazane, teraz spójrz na orbitale wodoru i azotu:
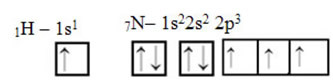
Zauważ, że niesparowany orbital wodoru, który wykona wiązanie sigma, to „s”, który jest przestrzennie reprezentowany przez okrąg; Orbitale azotowe są typu „p”, reprezentowane przez trzy podwójne jajowate (każdy w polu przestrzennym: x, y, z). Tak więc struktura cząsteczki HCN jest reprezentowana w następujący sposób:
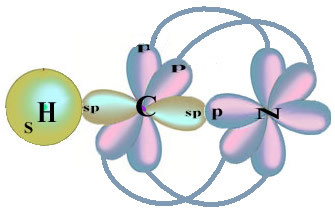
Jeśli chodzi o rodzaj wiązań występujących w tej strukturze formaldehydu to mamy:
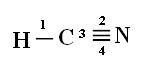
Znajomości: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
