W przemianie izotermicznej zmiany objętości i ciśnienia pewnego gazu, ale stała temperatura; stąd pochodzenie nazwy izotermicznej (gr.: iso = równe; termo = ciepło).
Naukowcy Boyle i Mariotte samodzielnie przeprowadzili podobne eksperymenty, a otrzymany wynik był następujący: wraz ze wzrostem ciśnienia zmniejsza się objętość gazu.
Pomyśl na przykład o tłoku strzykawki. Jeśli na ten tłok przyłożymy nacisk zewnętrzny, czyli zwiększymy ciśnienie, zmniejszy się objętość powietrza zajmowanego wewnątrz strzykawki i odwrotnie.
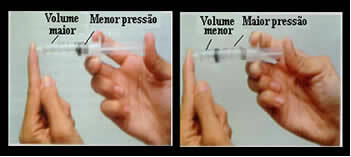
Objętość i ciśnienie są odwrotnie proporcjonalne: w lewym polu ciśnienie jest małe, a objętość zajmowana przez powietrze jest duża. Po prawej stronie, gdy na tłok strzykawki wywierany jest większy nacisk, objętość maleje.
Nie jest to odosobniony przypadek, jest to coś, co powtarza się z powszechną regularnością dla gazów. Dlatego fakt ten został określony w formie ustawy, którą można opisać następująco:
| Prawo Boyle'a lub Prawo Boyle-Mariotte: W stałej temperaturze objętość zajmowana przez stałą masę gazu jest odwrotnie proporcjonalna do jego ciśnienia. |
Oznacza to, że jeśli podwoimy ciśnienie gazu, jego objętość zmniejszy się o połowę i tak dalej. Gdy dwie takie wielkości są odwrotnie proporcjonalne, ich iloczyn jest stały; zatem matematycznie zależność tę można przedstawić w następujący sposób:
| PV = k |
Gdzie k = stała.
Jeśli więc w pierwszej sytuacji mamy wartość ciśnienia danego gazu jako P1 i odpowiednią objętość jako V1, to musimy:
| P1. V1 = k |
Jeśli zwiększymy to ciśnienie do P2, jego objętość również zmieni się na V2 i znowu będziemy musieli:
| P2 . V2 = k |
W ten sposób dochodzimy do wniosku:
| P1. V1 =P2. V2 |
Stałość tę można zobaczyć na przykładzie podanym w poniższej tabeli, ciśnień i objętości gazu o stałej masie:
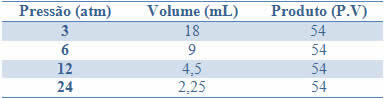
Wykreślając te wartości na wykresie, zobaczymy, jak powstaje krzywa.
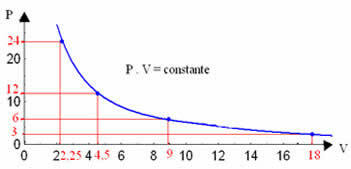
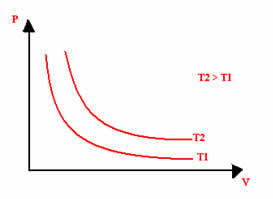
Graficzna reprezentacja przemiany izotermicznej będzie zawsze hiperbolą, niezależnie od wartości ciśnienia i objętości oraz temperatury, w których przeprowadzono eksperyment. Ta hiperbola nazywa się izoterma; więc, jak widać na poniższym wykresie, różne temperatury powodują powstawanie różnych izoterm.
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm
