Niektóre związki nie muszą mieć ośmiu elektronów w powłoce walencyjnej, aby osiągnąć stabilność, więc są uważane za wyjątki od reguły oktetu. Dowiedz się teraz, dlaczego niektóre pierwiastki wymykają się obowiązkowi posiadania oktetu elektronów w ostatniej powłoce.
Beryl (Być)
Jest to wyjątek od reguły oktetu, ponieważ jest w stanie tworzyć związki z dwoma pojedynczymi wiązaniami, więc stabilizuje się tylko czterema elektronami w powłoce walencyjnej. 
Ponieważ wodór (H) musi oddać dwa elektrony, aby utworzyć wiązanie (H - Cóż - H), atom berylu (Be) dzieli swoje elektrony i osiąga stabilność.
Aluminium (Glin)
Jest to wyjątek od reguły oktetu, ponieważ osiąga stabilność z sześcioma elektronami w powłoce walencyjnej. Atom glinu ma tendencję do oddawania swoich elektronów i może tworzyć trzy pojedyncze wiązania z innymi atomami: 
W tym przypadku aluminium (Al) utworzyło trzy wiązania z trzema atomami fluoru (F).
Bor (B)
Tworzy substancje molekularne z trzema pojedynczymi wiązaniami. 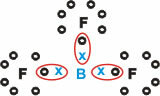
Zauważ, że bor (B) ma tendencję do przekazywania swoich elektronów atomom fluoru (F), co jest zgodne z regułą oktetu, wymagającą ośmiu elektronów w powłoce walencyjnej. Ponieważ bor oddaje swoje elektrony, fluor stabilizuje się wraz z utworzonym oktetem.
Liria Alves
Absolwent chemii
Brazylijska drużyna szkolna
Zobacz więcej!
Teoria oktetów
Chemia ogólna - Chemia - Brazylia Szkoła
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm
