A elektrosfera jest obszarem atomu, w którym elektrony Znajdują się. Dokładniej mówiąc, elektrosfera składa się z orbitali atomowych, określonych poprzez rozwiązanie równania Schrödingera. Elektrosfera, określona po raz pierwszy w modelu Rutherforda, osiągnęła znaczny postęp w okresie obowiązywania modelu atomowego Bohra.
Elektrosferę można podzielić na warstwy (lub poziomy energii), ponieważ elektrony zdefiniowały (nieciągłą) energię. W przypadku atomów z dwoma lub większą liczbą elektronów powłoki dzielą się na podpowłoki (lub podpowłoki). Elektrosfera jest niezwykle ważna dla zrozumienia właściwości atomu i zrozumienia powstawania wiązań chemicznych.
Przeczytaj też: Jak dzieli się atom?
Podsumowanie o elektrosferze
Elektrosfera to obszar atomu, w którym znajdują się elektrony.
Składa się z orbitali atomowych, funkcji falowych będących rozwiązaniami równań Schrödingera.
Jej koncepcja rozpoczęła się od modelu Ernesta Rutherforda.
Elektrony utrzymują się w elektrosferze dzięki przyciąganiu do jądra atomowego.
Główny postęp w zrozumieniu elektrosfery nastąpił podczas koncepcji modelu Nielsa Bohra.
Składa się z warstw (lub poziomów energii), które są obszarami o określonej energii.
W przypadku atomów mających więcej niż jeden elektron powłoki dzielą się na podpowłoki (lub podpowłoki).
Elektrosfera jest ważna dla zrozumienia kilku właściwości, takich jak podobieństwo atomów, stabilność, promień atomowy, energia jonizacji, powinowactwo elektronowe, a także zrozumienie powstawania wiązań chemikalia.
Lekcja wideo na temat elektrosfery
Co to jest elektrosfera?
Elektrosferę definiuje się jako obszar struktury atomowej, w którym znajdują się elektrony. W bardziej pogłębionych interpretacjach mówimy, że składa się ona z orbitali atomowych, czyli funkcji falowych będących rozwiązaniami równania Schrödingera. Matematyczne wyrażenie orbitalu atomowego podniesione do kwadratu przedstawia gęstość prawdopodobieństwa położenia elektronu w danym punkcie.
O Koncepcja elektrosfery zaczęła się pojawiać wraz z pojawieniem się Model atomu Ernesta Rutherforda, w którym elektrony krążą wokół gęstego, dodatniego jądra. Później Niels Bohr przedstawił bardziej znaczące interpretacje elektrosfery, mieszając koncepcje mechaniki kwantowej.
Warstwy elektrosfery
Elektrony utrzymują się w elektrosferze dzięki przyciąganiu do jądra atomowego. Wiadomo jednak, że te elektrony znajdują się na powłokach, których energie są dobrze określone. Warstwy takie można również nazwać poziomami energetycznymi.
Do takiego wniosku doszło po eksperymentach spektroskopowych. Na przykład, gdy prąd elektryczny zostanie przyłożony do gazu H2 Przy niskim ciśnieniu światło jest emitowane przez H2. W tym stanie powstają jony H+ i elektrony, które powrócą do jonów H+ i utworzą wzbudzone (pobudzone) gatunki H+. Aby uwolnić nadmiar energii, jony H+ uwalniają energię w postaci promieniowania elektromagnetycznego (światła) i rekombinują w gazowy H2 Ponownie.
Być może pamiętasz, że białe światło przechodzące przez pryzmat rozpada się na widmo ciągłe (podobne do tęczy); jednakże to samo nie ma miejsca w przypadku światła pochodzącego z H2: gdy takie promieniowanie przechodzi przez pryzmat, w widmie emisyjnym H widoczne są jedynie jasne linie o określonej długości fali2, zwane liniami widmowymi.
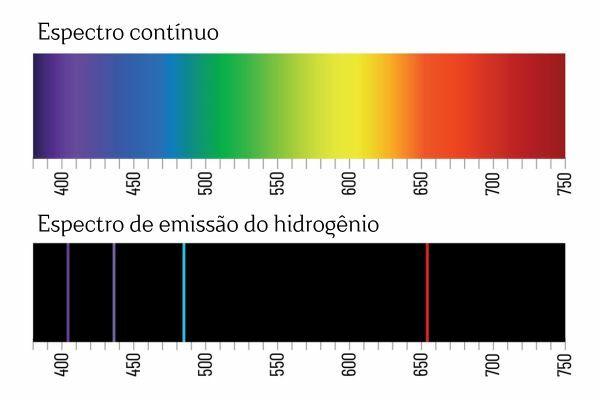
Interpretacja widm emisyjnych pierwiastków (z dobrze określonymi liniami widmowymi) jest następująca elektron, w atomie, nie może przedstawiać żadnej energii, ale raczej w dobrze określonych ilościach (tzw. pakiety energetyczne). Gdyby elektrony nie miały takich ograniczeń energetycznych, widmo emisji pierwiastków byłoby ciągłe, podobnie jak widmo światła białego przechodzącego przez pryzmat.
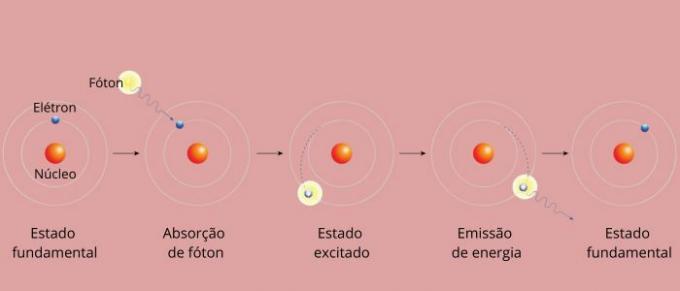
Każda linia widmowa pierwiastka stała się znana jako poziom energii. (lub warstwa, jak jesteśmy przyzwyczajeni do mawiania). Linie te powstają, gdy elektron przechodzi z jednego dozwolonego poziomu energii na inny w procesie zmiany energii zwanym przejściem elektronowym.
Podczas przejścia elektronowego elektron przechodzi z niższego poziomu energetycznego na wyższy. Powracając do swojego początkowego poziomu, emituje nadmiar energii poprzez promieniowanie elektromagnetyczne (światło), dając początek linii widmowej, której wartość wyemitowanej energii jest proporcjonalna do wartości określonej równaniem Rydberga.
Johannes Rydberg był szwedzkim spektroskopistą, który stworzył równanie określające trend linii widmowych w oparciu o prace szwajcarskiego profesora Johanna Balmera. Energię właściwą każdej warstwy definiuje się rozwiązując odpowiednie równanie Schrödingera.
Każda warstwa elektronowa ma dozwoloną liczbę elektronów. Obecnie zdefiniowanych jest siedem warstw elektronicznych, oznaczonych literami od K do Q w kolejności alfabetycznej lub literą n, gdzie n ≥ 1. Zatem warstwa K jest warstwą, w której n = 1 i tak dalej. Liczbę elektronów dozwoloną na powłokę pokazano w poniższej tabeli.
Poziom energii |
Warstwa |
Maksymalna liczba elektronów |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
O |
32 |
6 |
P |
18 |
7 |
Q |
8 |
W przypadku atomów wodoroidowych (z tylko 1 elektronem, takich jak H, He+, Li2+), wszystkie orbitale atomowe mają tę samą energię (nazywamy je orbitalami zdegenerowanymi); jednakże w atomach z dwoma lub więcej elektronami powstaje bardzo ważny efekt, odpychanie elektron-elektron. Konsekwencją tego faktu jest to, że orbitale każdej warstwy zaczynają mieć różne energie i dlatego warstwy zaczynają być opisywane jako podwarstwy (lub podpoziomy).
W przypadku obecnych atomów każdą warstwę można rozłożyć na maksymalnie cztery podpoziomy, reprezentowane przez litery „s” (z angielskiego, ostry), „p” (z angielskiego, główny), „d” (z angielskiego, rozproszone) i „f” (z angielskiego, fundamentalny).
Każdy podpoziom obsługuje maksymalną liczbę elektronów, określoną na podstawie obliczeń i eksperymentów. Podpoziom „s” obsługuje do 2 elektronów; podpoziom „p” do 6 elektronów; podpoziom „d” do 10 elektronów; i podpoziom „f” do 14 elektronów. Warstwa K jest jedyną, która pozwala na tylko jeden orbital i dlatego ma tylko jeden poziom podrzędny.
Poziom energii |
Warstwa |
Podpoziomy |
1 |
K |
1s |
2 |
L |
2s, 2p |
3 |
M |
3s, 3p, 3d |
4 |
N |
4s, 4p, 4d, 4f |
5 |
O |
5s, 5p, 5d, 5f |
6 |
P |
6s, 6p, 6d |
7 |
Q |
7s, 7p |
Funkcja elektrosfery
Elektrosfera każdego atomu można wykorzystać do wyjaśnienia różnych właściwości i zachowań atomu.
Właściwości takie jak promień atomowy, promień jonowy, energia jonizacji i powinowactwo elektronowe mają wartości, które są bezpośrednią konsekwencją konfiguracji elektronowej elektrosfery, a dokładniej zwana powłoką walencyjną, który w rzeczywistości jest najbardziej zewnętrzną zajętą powłoką elektroniczną atomu lub jonu.
A podobieństwo pomiędzy atomami z tej samej grupy w układzie okresowym jest również konsekwencją konfiguracji elektronowej powłoki walencyjnej. W procesach chemicznych wybieramy w miarę możliwości atomy z tej samej grupy układu okresowego podstawniki i jest to jedynie prawdopodobne, ponieważ atomy te mają tę samą konfigurację elektronową w warstwie wartościowości.
Do wiązania chemiczne, które zachodzą między atomami, tworząc związki jonowe i kowalencyjne (cząsteczki), zachodzą również w wyniku interakcji między elektrosferami atomów.
Przeczytaj też: Model atomu Schrödingera — sposób opisu atomu za pomocą mechaniki kwantowej
Związek pomiędzy elektrosferą a strukturą atomową
Jak zauważono, elektrosfera obejmuje obszar atomu, w którym można znaleźć elektrony. Dokładniej mówiąc, elektrony znajdują się na orbitaliach atomowych, których energia jest zdefiniowana na podstawie obliczeń kwantowych.
Elektrosfera jest największym obszarem struktury atomowej, ponieważ jądro atomu jest bardzo małe. Myśląc o atomie jak o stadionie piłkarskim, jądro odpowiadałoby piłce znajdującej się w środku boiska, podczas gdy reszta stadionu stanowiłaby elektrosferę.
Niemniej jednak, pod względem masy elektrosfera wnosi niewielki wkład. Ponieważ masa elektronów jest około 1836 razy mniejsza od masy protonów i neutronów, można powiedzieć, że prawie cała masa atomu skupiona jest w jądrze.
Rozwiązane ćwiczenia dotyczące elektrosfery
Pytanie 1
(Facisb 2023) W modelu Bohra atomu wodoru elektron może zajmować tylko określone orbity. Niektóre z tych orbit przedstawiono na rysunku, gdzie n odnosi się do poziomów energii elektronu na każdej orbicie.
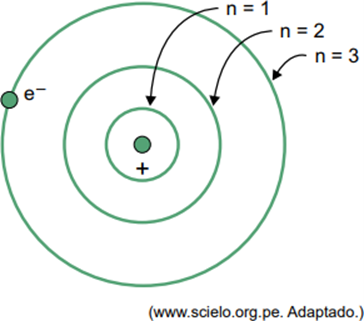
Rozważmy, że w atomie wodoru elektron znajduje się na orbicie, gdzie n = 5.
Według modelu Bohra elektron ten będzie emitował energię w postaci promieniowania elektromagnetycznego tylko wtedy, gdy
(A) przejdź na orbitę, na której n jest równe 6.
(B) pozostać na orbicie, gdzie n = 5.
(C) przejście na dowolną orbitę, na której n jest większe niż 5.
(D) przejście na dowolną orbitę, na której n jest mniejsze niż 5.
(E) jest wyrzucany z atomu, jonizując go.
Odpowiedź: Litera D
Kiedy elektron znajduje się w powłoce zewnętrznej, po powrocie do powłoki wewnętrznej o niższej energii uwalnia nadmiar energii w postaci promieniowania elektromagnetycznego (światła). Dlatego pojawienie się światła nastąpi dopiero wtedy, gdy elektron obecny w n = 5 przejdzie na wewnętrzną powłokę.
pytanie 2
(Uerj 2019) Niedawno naukowcom udało się wyprodukować wodór metaliczny poprzez sprężanie wodoru cząsteczkowego pod wysokim ciśnieniem. Właściwości metaliczne tego pierwiastka są takie same jak pozostałych pierwiastków z grupy 1 układu okresowego.
Podobieństwo to związane jest z najbardziej energetycznym podpoziomem tych pierwiastków, który odpowiada:
(A) ns1
(B) n.p.2
(C) nie3
(D) nr4
Odpowiedź: Litera A
Atom wodoru ma tylko jeden elektron, który znajduje się na pierwszym poziomie, podpoziomie „s” (1s1). Jednym z powodów, dla których znajduje się w grupie 1 układu okresowego, jest to, że wszystkie inne pierwiastki chemiczne w tej grupie mają atomy, których powłoka walencyjna jest tego samego typu (ns1). Dlatego też, dzięki podobnej warstwie walencyjnej, możliwe było wytwarzanie wodoru w tej metalicznej postaci.
Źródła:
DO CANTO, E. L.; LEITE, L. L. W.; CANTO, L. W. Chemia – w życiu codziennym. 1. wyd. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Zasady chemii: kwestionowanie życia i środowiska. 7. wyd. Porto Alegre: Bookman, 2018.
ATKINS, P.; DE PAULA, J.; KEELER, J. Chemia fizyczna Atkinsa. 11 wyd. Oksford: Oxford University Press, 2018.
