podwójna sól to nazwa nadana jednej z klasyfikacji, które sole nieorganiczne Może odbierać. Pozostałe klasyfikacje to: proste, ałunhydroksylowany, uwodorniony i nawodniony. Aby być scharakteryzowana jako sól podwójna, sól nieorganiczna musi mieć jedną z kombinacji opisanych poniżej:
Kation (Y) i dowolne dwa aniony (X i W) i jest reprezentowane przez następujący wzór:
YXW
Anion (X) i dowolne dwa kationy (Y i Z) i jest reprezentowane przez następujący wzór:
YZX
Uwaga: Te sole powstają, gdy Reakcja neutralizacji jest wykonywany między dwojgiem podstawy inny i jeden kwaslub między dwoma różnymi kwasami i zasadą.
Zasada nazewnictwa dla podwójnej soli
Aby nazwać podwójna sól, należy najpierw poznać jej budowę, ponieważ dla każdego rodzaju soli podwójnej istnieje specyficzna reguła nomenklatury, jak widać poniżej:
a) Reguła nomenklatury dla soli podwójnej z dwoma kationami
Kiedy jeden podwójna sól ma dwa kationy, musimy zastosować następującą zasadę:

Reguła nomenklatury stosowana dla soli podwójnych z dwoma kationami
Oto dwa przykłady zastosowania tej reguły nazewnictwa:
Pierwszy przykład: Linia4s
Ta sól składa się z:
Anion: siarczek (S-2);
Więcej kationów elektrododatnich: lit (Li+1);
Mniej elektrododatni kation: amon (NH4+1).
Stąd jego nazwa to (podwójny) siarczek amonu litu.
Drugi przykład: RbCaBO3
Ta sól składa się z:
Anion: boran (BO3-3);
Bardziej elektrododatni kation: rubid (Rb+1);
Mniej kationów elektrododatnich: wapń (Ca+2).
Tak więc jego nazwa to boran (podwójny) rubidu i wapnia.
b) Reguła nomenklatury dla soli podwójnej z dwoma anionami
Kiedy jeden podwójna sól ma dwa aniony, musimy zastosować następującą zasadę:
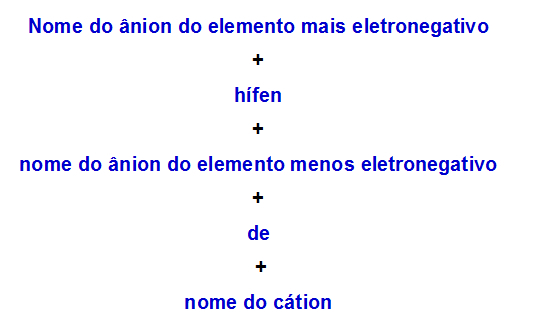
Reguła nomenklatury stosowana dla soli podwójnych z dwoma anionami
Oto dwa przykłady zastosowania tej zasady:
Pierwszy przykład: MgFI
Ta sól składa się z:
Kation: magnez (Mg+2);
Najbardziej elektroujemny anion: fluorek (F-1);
Mniej elektroujemny anion: jodek (I-1).
Dlatego jego nazwa to fluorek magnezu.
Drugi przykład: ZnNO2br
Ta sól składa się z:
Kation: cynk (Zn+2);
Więcej elektroujemnych anionów: azotyn (NO2-1);
Mniej elektroujemny anion: bromek (Br-1).
Stąd jego nazwa to bromek azotynu cynku.
Zestawienie formuły soli podwójnej z jej nomenklatury
a) Dla soli podwójnej z dwoma kationami
Konstrukcja formuły a podwójna sól polega na znajomości jego nazwy, która jest standaryzowana jak w każdej soli, czyli najpierw kation, a potem anion. Ponieważ sól podwójna może mieć dwa kationy, ich kolejność i rozmieszczenie w formule są zgodne z podaną nazwą.
Pierwszy przykład: pirofosforan barowo-niklowy II
Ta sól zawiera fosforan (P2O7), bar (Ba+2) i nikiel II (Ni+2), kationy zapisane w tej kolejności. Więc jego formuła to BaNiP2O7.
Drugi przykład: fosforan miedzi II i złoto I
Ta sól zawiera fosforany (PO4-3), miedź II (Cu+2) i złoto I (Au+1), kationy zapisane w tej kolejności. Dlatego jego formuła to CuAuPO4.
b) Dla soli podwójnej z dwoma anionami
W przypadku podwójna sól w przypadku dwóch anionów kierujemy się również, umieszczając aniony we wzorze, w kolejności, w jakiej występują w podanej nazwie.
Pierwszy przykład: jodek siarczanu niklu III
Ta sól ma aniony siarczanowe (SO4-2) i jodek (I-1), zapisane w tej kolejności, oraz kation niklu III (Ni+3). Więc jego formuła to NiSO4JA.
Drugi przykład: fosforan cyjanku ołowiu IV
Ta sól zawiera aniony fosforanowe (PO4-3) i cyjanek (CN-1), zapisany w tej kolejności, oraz kation ołowiu IV (Pb+4). Więc jego formuła to PbPO4CN.
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm
