Równowaga dynamiczna lub równowaga chemiczna reakcji występuje, gdy reakcje postępujące i odwrotne zachodzą jednocześnie. Te tak zwane systemy odwracalne są reprezentowane przez strzałki w obu kierunkach:  lub
lub  . Przykład odwracalnej reakcji jest przytoczony na powyższym obrazku, między gazowym jodem a gazowym wodorem.
. Przykład odwracalnej reakcji jest przytoczony na powyższym obrazku, między gazowym jodem a gazowym wodorem.
Na początku reakcji ilość reagentów jest maksymalna, a produktów zero. Reagenty reagują jednak ze sobą, zmniejszając ich stężenie i zwiększając stężenie powstających produktów. Zmniejsza się również tempo rozwoju reakcji bezpośredniej.
Wraz ze wzrostem stężenia produktów rozpoczyna się reakcja odwrotna i reagenty powstają ponownie; wzrasta również tempo rozwoju reakcji odwrotnej.
Po osiągnięciu równowagi chemicznej, w stałej temperaturze, szybkości rozwoju reakcji do przodu i do tyłu są równe.
Wszystkobezpośredni = Wszystkie odwrotność
Stawki są takie same, ale stężenia nie. Stężenia odczynników i produktów prawdopodobnie nie będą takie same. Tylko w rzadkich przypadkach tak się dzieje. W większości przypadków stężenie odczynników będzie wyższe niż produktów lub odwrotnie.
Mamy zatem trzy możliwe sposoby graficznego przedstawienia tempa rozwoju reakcje bezpośrednie i odwrotne, związane ze stężeniem reagentów i produktów w ciągu czas. Spójrzmy na każdy przypadek:
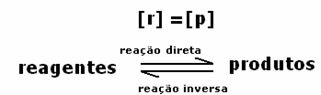
1. przypadek: Równe stężenia:
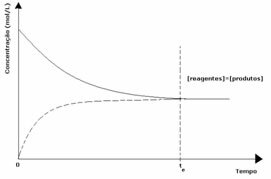
Jak widać na wykresie, w czasie ti reakcje w przód i w tył są takie same, w tym przypadku stężenia reagentów i produktów są takie same. W ten sposób równowaga nie jest przesunięta w żadną stronę, intensywność obu reakcji jest taka sama, jak wyrażono poniżej:
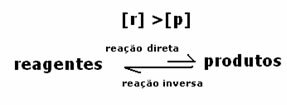
Drugi przypadek: Stężenie odczynników większe niż stężenie produktów:
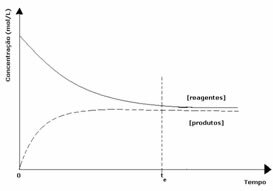
W tym przypadku obserwuje się, że po osiągnięciu równowagi stężenie reagentów jest większe niż produktów. Stwierdza się zatem, że im więcej reagentów, reakcja odwrotna zachodzi z większą intensywnością. Reakcja jest przesunięta w lewo:
Trzeci przypadek: Stężenie produktów większe niż odczynników:
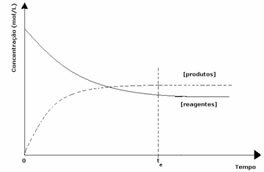
Ponieważ w stanie równowagi stężenie produktów jest większe, oznacza to, że reakcja jest przesunięty w prawo, ponieważ reakcja bezpośrednia (z tworzeniem produktów) zachodzi z większym intensywność.
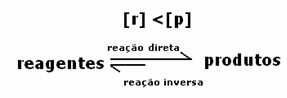
Tym, co wskaże, czy reakcja przebiega w prawo, czy w lewo, będzie stała równowagi K, która zależy tylko od temperatury.
Jennifer Fogaça
Absolwent chemii
Brazylijska drużyna szkolna
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm
