Roztwór buforowy jest zwykle mieszaniną słabego kwasu i soli tego kwasu lub słabej zasady i soli tej zasady. To rozwiązanie ma na celu zapobieganie występowaniu bardzo dużych zmian pH lub pOH roztworu.
Poniżej kilka przykładów roztworów buforowych:
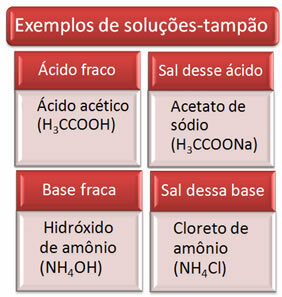
Skuteczność roztworu buforowego widać w naszej krwi, gdzie nawet przy dodaniu kwasu lub zasady w niewielkich ilościach do osocza krwi praktycznie nie ma zmiany jego pH.
Jak to się dzieje, skoro jeśli dodamy do wody kwasy lub zasady, jej pH szybko się zmienia?
Krew ludzka jest nieco podstawowym układem buforowym, to znaczy jest cieczą buforowaną: jej pH pozostaje na stałym poziomie między 7,35 a 7,45. Jednym z najciekawszych i najważniejszych buforów we krwi jest kwas węglowy (H2WSPÓŁ3) i przez sól tego kwasu, wodorowęglan sodu (NaHCO3).
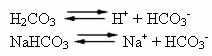
Tak więc w tym roztworze buforowym znajdują się następujące gatunki:
H2WSPÓŁ3: występuje w dużych ilościach, ponieważ jest słabym kwasem, słabo ulega jonizacji;
H+: z jonizacji H2WSPÓŁ3;
HCO3-: występuje również w dużych ilościach, z jonizacji H2WSPÓŁ3 i dysocjacja soli (NaHCO3);
W+: z jonizacji NaHCO3;
Jeśli do tego roztworu doda się niewielkie stężenie kwasu, nastąpi jego jonizacja, w wyniku której powstają kationy H+, który będzie reagował z anionami HCO3- obecny w pożywce, pochodzący z niezjonizowanego kwasu węglowego. Nie ma zmiany pH.
Po dodaniu zasady powstaną aniony OH-. Jony te łączą się z kationami H+, z jonizacji H2WSPÓŁ3. Tak więc aniony OH- są neutralizowane, utrzymując pH podłoża.
Oprócz wspomnianego roztworu buforowego, we krwi znajdują się jeszcze dwa inne, którymi są: H2KURZ4/HPO42- i niektóre białka. Gdyby we krwi nie było takich roztworów buforowych, zakres pH mógłby zostać poważnie zaburzony. Jeśli pH krwi wzrośnie powyżej 7,8, nazywa się to zasadowicą. Jeśli pH spadnie zbyt mocno, poniżej 6,8, będzie to stan kwasicy. Oba są niebezpiecznymi warunkami, które mogą prowadzić do śmierci.

Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm


