TENosmoza i przejście rozpuszczalnika, od mniej stężonego roztworu do bardziej stężonego roztworu, poprzez membrana półprzepuszczalna, aż ciśnienie wywierane przez roztwór na membranę uniemożliwi przechodzenie rozpuszczalnika. Ten proces ma na celu: zrównoważyć stężenie roztworu.
Przeczytaj też: Substancja rozpuszczalna i rozpuszczalnik
ciśnienie osmotyczne
TEN ciśnienie osmotyczne i ciśnienie wywierane na roztwór o większym stężeniu aby nie wystąpiła osmoza, to znaczy, aby rozpuszczalnik nie przechodził przez półprzepuszczalną membranę.
Ciśnienie osmotyczne jest wykorzystywane w procesach odsolenie wody, wymuszając proces odwrócona osmoza, powodując przejście rozpuszczalnika z bardziej stężonego roztworu do mniej stężonego. Nazywamy ten proces odwrócona osmoza. Zobacz poniższy obraz, który porównuje te dwa procesy:
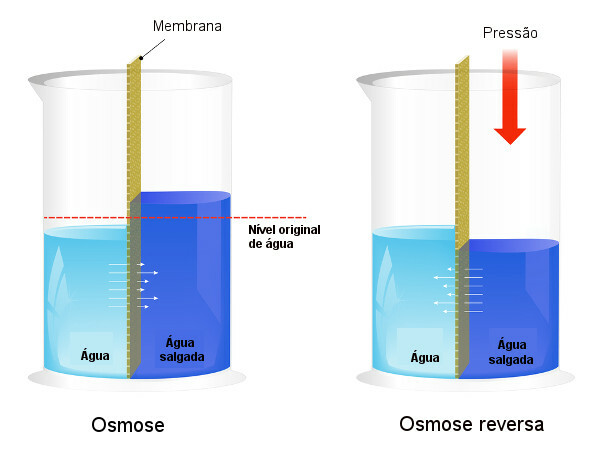
Należy zauważyć, że w osmozie przepływ rozpuszczalnika odbywa się w kierunku najbardziej stężonego roztworu, a w osmozie odwróconej przepływ jest w kierunku przeciwnym, ze względu na przyłożone ciśnienie. Aby dowiedzieć się więcej na ten temat, przeczytaj nasz tekst:
ciśnienie osmotyczne.wiedzieć więcej: Odwrócona osmoza w odsalaniu wody morskiej
równanie ciśnienia osmotycznego
Ciśnienie osmotyczne, reprezentowane przez literę pi (π) rozwiązania można obliczyć za pomocą następującego równania:
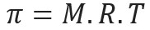
M = stężenie w mol/L
R = uniwersalna stała gazów doskonałych
T = temperatura bezwzględna, w K
jak inni właściwości koligatywne, ciśnienie osmotyczne zależy od stężenie roztworu, to znaczy im większe stężenie roztworu, tym większy wpływ osmozy na roztwory, a zatem tym większe ciśnienie osmotyczne.
Przykłady
Osmoza pojawia się w naszym codziennym życiu w różnym czasie. Możemy przytoczyć przykład proces solenia mięsa dla Twojej ochrona. ty mikroorganizmy który spowodowałby degradację mięsa stracić wodęod wewnątrz na zewnątrz, który ma koncentrację soli, dzięki czemu jedzenie trwa dłużej.
Ze względu na sól zdarza się również, że liście sałaty więdną za utratę wody z wnętrza ich komórki (trochę mniej skoncentrowany) dla hartowane rozwiązanie w środowisku zewnętrznym.
Osmoza jest również ważna, gdy mówimy o krew człowiek. Mówimy, że Czerwone komórki a krew jest jedna ośrodek izotoniczny, to znaczy mają takie samo ciśnienie osmotyczne, co pozwala na łatwe wchodzenie i wychodzenie wody z komórki.
Jednakże, gdy krew staje się mniej skoncentrowana niż wewnątrz czerwonych krwinek (ośrodek hipotoniczny), przepływ wody będzie łatwiejszy do wewnątrz komórki, dzięki czemu puchnąć, aż pęknie. Jeśli krew osiągnie stężenie większe niż stężenie krwinek czerwonych (podłoże hipertoniczne), komórki krwi więdną, ponieważ tracą wodę.

Zgodnie z tą samą zasadą konserwacji mięsa, konserwacja owocóww kompotach z cukierków, którzy konserwują żywność z powodu wysokie stężenie cukru w rozwiązaniu.
Poniżej znajdują się inne przykłady, w których występuje osmoza:
- we wzroście soku w naczyniach przewodzących rośliny;
- w hemodializa;
- w selektywnym przechodzeniu składników odżywczych w komórkach ludzkiego ciała.
Aby zrozumieć, jak osmoza zachodzi w komórce zwierzęcej, komórce roślinnej i innych problemach biologicznych, przeczytaj: Osmoza: co to jest i jak występuje w komórce zwierzęcej i roślinnej.
Autor: Victor Ferreira
Nauczyciel chemii
