W zwykłe baterie są nazywane Baterie Leclanche nazwany na cześć jego wynalazcy, francuskiego chemika George'a Leclanché (1839-1882).

George Leclanche (1839-1882)
Leclanché stworzył ten typ baterii w 1866 roku. Nazywa się ją również suche komorki ponieważ do tej pory istniały tylko baterie wykorzystujące roztwory wodne, takie jak stos Daniella.
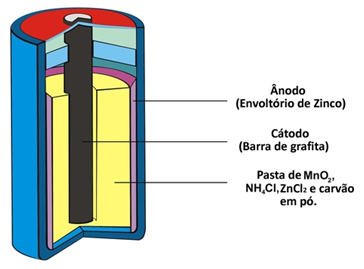
Dwie inne nazwy, które ten typ stosu otrzymuje ze względu na swoją budowę, to: stos kwasu lub bateria cynkowo-węglowa;. Zasadniczo składa się z otoczki cynkowej oddzielonej od innych związków chemicznych tworzących stos za pomocą porowatego papieru.
Cynk ten odpowiada ujemnemu biegunowi ogniwa lub anody, ponieważ utlenia się, tracąc dwa elektrony, zgodnie z poniższą reakcją:
Biegun ujemny - anoda: Zn (y) → Zn2+(tutaj) + 2 i-
Stos ten posiada również biegun dodatni katodę, czyli pręt grafitowy zainstalowany w środku pala otoczony dwutlenkiem manganu (MnO2), sproszkowany węgiel drzewny (C) i mokra pasta zawierająca chlorek amonu (NH4Cl), chlorek cynku (ZnCl2) i wody (H2O).
Chlorek amonu i chlorek cynku to sole o charakterze kwasowym, stąd nazwa „ogniwo kwasowe”.
Pręt grafitowy przewodzi elektrony utracone przez cynk do manganu, redukując dwutlenek manganu (MnO)2) do trójtlenku manganu (Mn2O3), zgodnie z następującą półreakcją:
Biegun dodatni - katoda: 2 MnO2(aq) + 2 NH41+(tutaj) + 2e- → 1 mln2O3(y) + 2NH3(g) + 1 godzina2O(1)
Mokra pasta działa jak punkt soli, umożliwiając migrację anionów hydroksylowych (OH-) od grafitu do cynku.
Ogólna reakcja wyrażana jest wzorem:
Zn (y) + 2 MnO2(aq) + 2 NH41+(tutaj) → Zn2+(tutaj) + 1 mln2O3(y) + 2NH3(g)
W związku z tym baterie te nie nadają się do ponownego naładowania, ponieważ cały dwutlenek manganu jest przekształcany w trójtlenek manganu. Gdy bateria przestanie działać, należy ją wyrzucić.
Ddp tych baterii wynosi 1,5V. Jednak amoniak (NH3(g)) powstające na katodzie mogą osadzać się na pręcie grafitowym, utrudniając przechodzenie elektronów i zmniejszając napięcie baterii. Aby powrócić do normalnej pracy, wystarczy pozostawić baterię na zewnątrz urządzenia, ponieważ kation cynku (Zn2+(tutaj)) utworzony na anodzie reaguje z amoniakiem, pozostawiając wolną sztabkę grafitu.
Ponadto umieszczenie stosu w lodówce również może pomóc, ponieważ obniżenie temperatury sprzyja rozpuszczalności amoniaku w wilgotnej paście w stosie.
Innym ważnym czynnikiem dotyczącym suchych ogniw Leclanché, który musimy wziąć pod uwagę, jest to obudowa cynkowa może korodować, a tym samym wyciekać materiał żrący i uszkodzić urządzenie.. Dlatego najlepiej nie zostawiać baterii w urządzeniach, które nie są używane w sposób ciągły.
Suche baterie są wskazane do urządzeń wymagających lekkiego i ciągłego rozładowania, takich jak pilot, zegar ścienny, przenośne radio i zabawki.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm

