Gdyby można było bardzo wyraźnie zwizualizować strukturę metalu, zobaczylibyśmy ją tak, jak na powyższym obrazku. Struktura atomowa metali jest krystaliczna, która składa się z kationów metali otoczonych elektronami.
Sieci krystaliczne obecne w metalach można przedstawić w następujący sposób: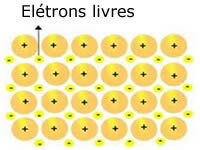
Reprezentacja metalicznego sodu (Na)
Sieci krystaliczne metali są tworzone przez grupę stałych kationów.
Każdy kation Na+ jest otoczony elektronami, ale są one zdelokalizowane, to znaczy nie są przyciągane do żadnego jądra.
Ponieważ nie ma przyciągania między ładunkami ujemnymi (elektron) a dodatnim jądrem (kation), wolne elektrony w końcu zajmują całą sieć krystaliczną metalu. Swoboda, jaką mają elektrony, powoduje, że tworzą one chmurę elektroniczną.
Zdolność metali do przewodzenia elektryczności tłumaczy się obecnością tej chmury. Prąd elektryczny powstaje w wyniku kontaktu wolnych elektronów z innymi metalami.
W składzie dowolnego atomu, w tym metali takich jak sód (Na), złoto Au, miedź (Cu), znajduje się warstwa walencyjna. Elektrony poruszają się swobodnie przez tę warstwę, utrzymując elektromagnetyczne przyciąganie kationów. Ta właściwość strukturalna pozwala na tworzenie cząsteczek metalicznych, a w konsekwencji samych metali.
Liria Alves
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm