Zdolność połączeń do przyciągania ładunków elektrycznych określana jest jako Polaryzacja, która przybiera inny charakter w zależności od połączenia, w którym występuje.
Najczęstsze wiązania z udziałem związków organicznych występują między atomami węgla lub między atomami węgla i wodoru: C ─ C i C ─ H (węglowodory). Ten typ wiązania klasyfikujemy jako kowalencyjne, występuje we wszystkich wiązaniach związków organicznych tworzonych tylko przez węgiel i wodór.
Gdy w cząsteczce związku organicznego oprócz węgla i wodoru znajduje się jeszcze inny pierwiastek chemiczny, jego cząsteczki będą miały pewną polarność. Nazywamy ten pierwiastek heteroatomem i może to być między innymi: azot (N), tlen (O).
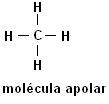
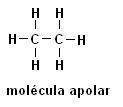
Metan (CH4) Etan (C2H6)
Należy zauważyć, że w obu strukturach nie ma obecności heteroatomów, w tym przypadku cząsteczki są klasyfikowane jako niepolarne.


Obecność tlenu jako heteroatomu sprawia, że cząsteczki wykazują polaryzację. Pierwszą cząsteczką jest związek Etanol (CH3CH2O), obecność grupy hydroksylowej – OH nadaje temu związkowi charakter polarny, nawet jeśli w swojej strukturze zawiera część niepolarną.
Liria Alves
Absolwent chemii
Brazylijska drużyna szkolna
Zobacz więcej! płaski izomer
Chemia organiczna - Chemia - Brazylia Szkoła
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm

