Do funkcje azotu są grupą związki organiczne które mają atomy azot przyczepiony do łańcucha węglowego. Wyróżniają się one odpowiednimi grupami funkcyjnymi, które są zbiorami atomów połączonych w określonej konfiguracji i które określają charakterystyczne właściwości każdej funkcji.
Funkcje azotu to:
aminy;
amidy;
związki nitrowe;
nitryle;
izonitryle.
Przeczytaj też:Jakie są funkcje tlenu?
Podsumowanie funkcji azotu
Funkcje azotu to związki organiczne, które zawierają atomy azotu.
Funkcje azotu to aminy, amidy, nitrozwiązki, nitryle i izonitryle.
Funkcje nieorganiczne wyróżnia ich grupa funkcyjna.
Aminy pochodzą z podstawienia wodory amoniaku przez rodniki alkilowe.
Amidy mają ten sam atom węgla połączony z azotem i węglem. tlen.
Związki nitrowe zawierają grupę -NO.2.
Nitryle charakteryzują się obecnością potrójnego wiązania pomiędzy węglem i azotem.
Izonitryle mają potrójne wiązanie między azotem a węgiel, z azotem przyłączonym do łańcucha węglowego.
Lekcja wideo na temat funkcji azotowych
Jakie są funkcje azotu?
Funkcje azotu to zbiór funkcje organiczne, które mają w swojej strukturze atom azotu, oprócz atomów węgla i wodoru. Są to: aminy, amidy, nitrozwiązki, nitryle i izonitryle,
Tym, co różnicuje funkcje azotowe, są odpowiednie grupy funkcyjne, które są strukturalnym układem atomów odpowiedzialnym za właściwości substancji.
Jakie są funkcje azotu?
aminy
Funkcja organiczna kopalnia jest charakteryzowany przez związanie co najmniej jednego łańcucha węglowego z atomem azotu. Grupa funkcyjna amin to -N-R1R2R3 (grupy R oznaczają łańcuchy węglowe lub atomy wodoru, z których co najmniej jeden jest łańcuchem węglowym).

aminy pochodzą z amoniaku (NH3), z jednym lub większą liczbą atomów wodoru zastąpionych atomami węgla lub ligandami alkilowymi. Są to substancje zasadowe, pozostawiające pH większa niż 7 w roztworze wodnym.
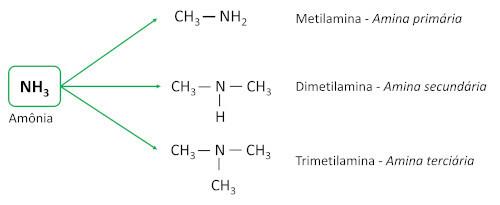
Są one klasyfikowane według ilości atomów wodoru zastąpionych przez ligandy węglowe (grupy alkilowe lub arylowe), które nazywane są podstawnikami.
- Aminy pierwszorzędowe: mają jeden podstawnik węglowy.
- Aminy drugorzędowe: mają dwa podstawniki węglowe.
- Aminy trzeciorzędowe: mają trzy podstawniki węglowe, to znaczy atom azotu nie jest już związany z żadnym atomem wodoru, tworząc trzy Znajomości proste z atomami węgla.
A nazewnictwo amin kieruje się wytycznymi IUPAC (Międzynarodowa Unia Chemii Czystej i Stosowanej). W przypadku amin pierwszorzędowych konstrukcja nazwy uwzględnia liczbę atomów węgla (przedrostek), charakter wiązania pomiędzy atomami węgla (wrostek) oraz stosowane określenie kopalnia dla sufiksu (koniec słowa).

Zobacz przykład:
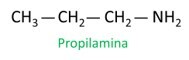
Przypisując numery atomom węgla w celu lokalizacji rodników, przypisz najniższą możliwą liczbę atomowi znajdującemu się najbliżej grupy NH.2.
W przypadku amin drugorzędowych i trzeciorzędowych nomenklatura uwzględnia najdłuższą grupę podstawnikową przyłączoną do atomu azotu jako główny łańcuch, a pozostałe ligandy są zapisywane z przedrostkiem odnoszącym się do liczby atomów węgla i sufiksem -il, z literą N przed nimi.

Przykład:
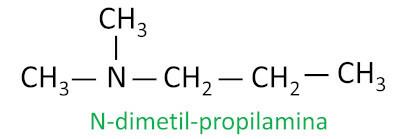
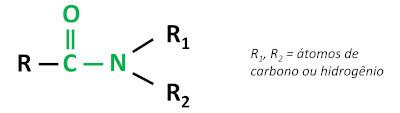
Amidy
Funkcja organiczna amid charakteryzuje się wiązanie grupy karbonylowej (C=O) z atomem azotu, gdzie azot może być związany z atomami węgla lub wodoru.
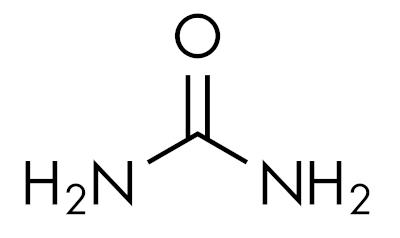
amidy są substancjami zasadowymi, pozostawiając pH powyżej 7 w roztworze wodnym. Substancja mocznik należy do grupy amidów i jest związkiem naturalnie występującym w moczu, pochodzącym z procesów degradacji zachodzących w organizmach żywych.
Amidy są charakterystyczne w zależności od stopnia podstawienia azotu. Lubię to:
- Amidy pierwszorzędowe: trzymać dwa atomy wodoru razem z azotem.
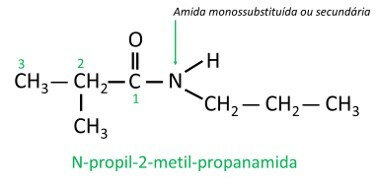
- Amidy drugorzędowelub monopodstawiony: jeden z wodorów został zastąpiony przez łańcuch węglowy, więc azot utrzymuje pojedyncze wiązanie z wodorem.
- amidy trzeciorzędowelub przemieszczone: Azot nie ma już wiązań wodorowych, z których wszystkie zostały zastąpione węglem.

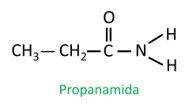
Amidy są Nazwany zgodnie z IUPAC, cząsteczki są nazwane według sekwencji:

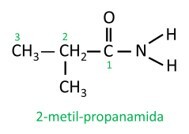
W rozgałęzionym amidzie atom węgla grupy amidowej uczestniczy w głównym łańcuchu i od niego musi zaczynać się liczba atomów węgla. Patrzeć:
 |
 |
W monopodstawionych lub dipodstawionych amidach, litera N wskazuje położenie gałęzi który jest przyłączony do atomu azotu. Jeśli w łańcuchu jest inny radykał, to zostanie on zapisany po zidentyfikowaniu radykała odwołującego się do N.
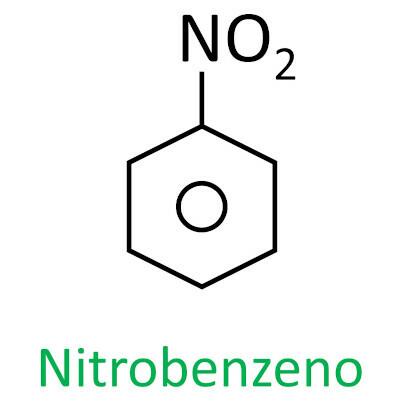
związki nitrowe
Ty związki nitrowe są związkami organicznymi, które zawierają grupę nitrową (-NO2) przymocowany do łańcucha węglowego, które mogą być alifatyczne (otwarte lub liniowe) lub aromatyczne.
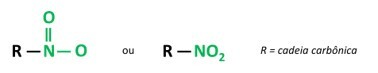
A Główną cechą tych substancji jest ich siła wybuchowa. Zdolność wybuchowa związana jest z nitrozwiązkami aromatycznymi, a im większa liczba grup nitrowych, tym większa eksplozja. Alifatyczne nitrozwiązki są stosowane w laboratoriach jako rozpuszczalniki organiczne.
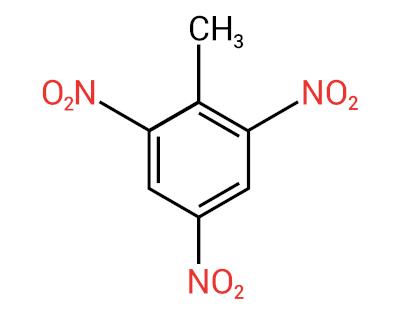
Nazewnictwo tych związków tworzy słowo nitro następnie imię i nazwisko węglowodór (przedrostek + wrostek + zakończenie -O).
Zobacz kilka przykładów:
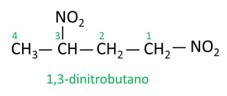 |
 |
nitryle
Nitryle to związki organiczne charakteryzujące się m.in potrójne wiązanie między atomem węgla i atomem azotu, przedstawiając grupę funkcyjną – C ≡ N. W nitrylach azot znajduje się na końcu, a węgiel jest przyłączony bezpośrednio do łańcucha węglowego.

nitryle Znany również jako cyjanki, ponieważ pochodzą one z reakcji z kwasem cyjanowodorowym (HCN).
są substancjami toksyczny dla ludzi, ponieważ w organizmie mogą tworzyć kwas cyjanowodorowy w kontakcie z kwasem żołądkowym, zapobiegając procesom oddychania komórkowego komórek.
W naturze nitryle można znaleźć w niektórych owocach pestkowych, ale w bardzo niskim stężeniu, które nie stanowi zagrożenia, oraz w liściach dzikiego manioku.

Reguła Iupac dotycząca nazewnictwa nitryli definiuje ten termin nitryl dodać jako sufiks:

Zobacz kilka przykładów:
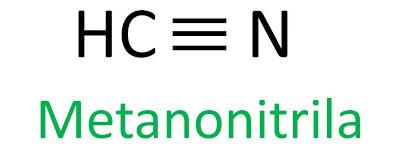 |
 |
Zwykła forma nomenklatury dla nitryli to cyjanek + rodnik nazwa.
izonitryle
Izonitryle lub izonitryle to związki utworzone przez potrójne wiązanie między atomem węgla i atomem azotu, przedstawiając grupę funkcyjną – R ≡ C. W izonitrylach węgiel znajduje się na końcu, a azot jest przyłączony bezpośrednio do łańcucha węglowego.

Izonitryle różnią się od nitryli położeniem atomów azotu i węgla oraz W izonitrylach azot jest charakteryzowany jako heteroatom., ponieważ znajduje się między dwoma atomami węgla.
Są niestabilnymi gatunkami i mogą przekształcić się w nitryle w podwyższonych temperaturach. W reakcjach kwasu izocyjanowego powstają izonitryle, dlatego związki te są również znane jako izocyjanki.
Cząsteczki izonitrylu są zgodne z regułą Iupac dotyczącą nazewnictwa:
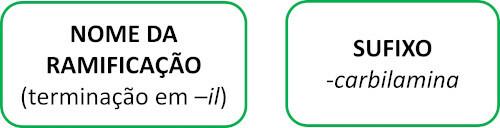
Zobacz kilka przykładów:
 |
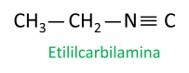 |
Zastosowania funkcji azotowych
Substancje należące do grup azotowych mają liczne zastosowania, głównie w przemyśle, do produkcji polimery, guma, włókna syntetyczne, farmaceutyki, agrochemikalia, pestycydy i materiały wybuchowe.
Do aminy są wykorzystywane do produkcji barwników, mydła, leki, w trakcie wulkanizacja gumy, materiałów wybuchowych i innych procesów przemysłowych, a także znajdują się w roślinach i powstają w procesach rozkładu materii organicznej.

Do amidy mają szerokie zastosowanie w przemyśle i przemyśle chemicznym, obecny w produkcji polimerów (takich jak nylon i poliuretan), żywic, materiałów wybuchowych, nawozy, środki odstraszające owady, nawozy i leki.

Ty związki nitroweJego głównym zastosowaniem jest produkcja materiałów wybuchowych. które znajdują zastosowanie w sektorze wojskowym, przemysłowym i metalurgicznym (do wydobycia surowców). Jednym z najbardziej znanych nitrozwiązków jest trinitrotoluen, popularnie zwany TNT. Inne zastosowania nitrozwiązków to produkcja pestycydy, środki bakteriobójcze, barwniki, rafinacja ropy naftowej itp.

Do nitryle są stosowane jako rozpuszczalniki organiczne w laboratorium i przemyśle, uczestnicząc w procesach ekstrakcji i wytwarzania niektórych włókien syntetycznych, polimerów tworzyw sztucznych, barwników i nawozów sztucznych.

Do izonitryle są stosowane w różnych procesach wytwarzania związków organicznych, takich jak rozpuszczalniki, oraz uczestniczą w produkcji agrochemikaliów, pestycydów, gumy i tworzyw sztucznych.
Przeczytaj też:Halogenki — substancje, które mają atomy halogenu przyłączone do łańcucha węglowego
Rozwiązane ćwiczenia dotyczące funkcji azotu
Pytanie 1
(modyfikowany FPS-PE) Zastosowanie związków azotu w syntetycznej chemii organicznej jest bardzo zróżnicowane i obejmuje wytwarzanie leków, barwników, materiałów wybuchowych i witamin. Spójrz na poniższe związki.
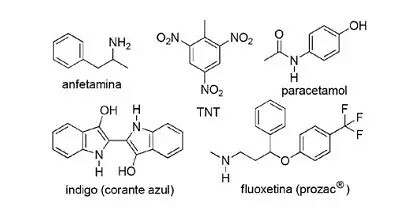
O tych związkach zaznacz błędne stwierdzenie.
a) TNT jest związkiem nitrowym.
b) Azotowa część fluoksetyny jest aminą drugorzędową.
c) Amfetamina zaliczana jest do amidów pierwszorzędowych.
d) Indygo ma w swojej strukturze pierścienie heteroaromatyczne.
e) Azotowa część paracetamolu to amid.
Rezolucja:
litera C
przedmiot The jest poprawne, ponieważ TNT jest związkiem nitrowym, ponieważ NIE ma grup2.
przedmiot B jest poprawne. Azotowa część fluoksetyny jest aminą drugorzędową, ponieważ jest połączona z dwoma segmentami węglowymi.
przedmiot w jest błędna, ponieważ amfetamina jest klasyfikowana jako amina pierwszorzędowa, a nie jako amid. Zauważ, że obecna grupa to NH2. Więc to jest sedno pytania.
przedmiot D jest poprawna, ponieważ indygo ma w swojej strukturze pierścienie heteroaromatyczne, czyli pierścienie utworzone z atomów węgla i innego pierwiastka — w tym przypadku azotu.
przedmiot To jest jest poprawna, ponieważ paracetamol jest amidem, zawierającym węgiel związany z azotem i tlenem.
pytanie 2
(UFMS) Yerba mate (Ilex paraguariensis), pochodzący z Ameryki Południowej, stosowany jest jako napój tonizujący i pobudzający. Produkt uzyskany w wyniku przetworzenia liści yerba mate może być wykorzystany do przygotowania chimarrão i tereré, wśród innych napojów powszechnie i kulturowo spożywanych w regionach Argentyny, Paragwaju i Brazylia. Duże zainteresowanie yerba mate wynika z obecnych w niej związków chemicznych, ze względu na jej właściwości przeciwutleniające, pobudzające i moczopędne.
(Dostępne w: http://repositorio.utfpr.edu.br/jspui/bitstream/1/3158/1/PG_PPGEP_Henrique%2C%20 Flavia%20Aparecida_2018.pdf. Dostęp w dniu: 01 listopada. 2018. Przystosowany).
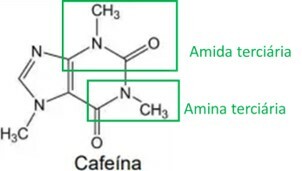
Pobudzające właściwości yerba mate są związane z zawartością w niej metyloksantyn, z których jedną z głównych jest kofeina, której skład przedstawiono poniżej:

Analizując wzór strukturalny kofeiny, należy stwierdzić, że pełni ona następujące funkcje i właściwości organiczne:
a) aldehyd i amid, zasadowe.
b) aminy i amidy, zasadowe.
c) aminy i ketony, zasadowe.
d) ketony i amidy, amfoteryczne.
e) kwas karboksylowy i amina, zasadowe.
Rezolucja:
Litera b
Analizując strukturę kofeiny, identyfikuje się aminowe i amidowe grupy funkcyjne, jak pokazano na poniższym obrazku. Ponieważ te dwie grupy mają właściwości zasadowe lub zasadowe, kofeina również ma tę właściwość, co oznacza, że wodne roztwory kofeiny mają pH powyżej 7.
Ana Luiza Lorenzen Lima
Nauczyciel chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/funcoes-nitrogenadas.htm
