A sublimacja Jest to zmiana stanu fizycznego materii charakteryzująca się bezpośrednim przejściem z fazy stałej do fazy gazowej, z pominięciem fazy ciekłej. Ściśle mówiąc, sublimacji może ulec każda substancja, ale w określonych warunkach ciśnienia i temperatury. Sublimacja jest skorelowana z prężnością pary w fazie stałej, a także z interakcjami międzycząsteczkowymi wywieranymi przez ciała stałe.
Proces ten można łatwo zaobserwować w kawałku suchego lodu, który składa się ze stałego dwutlenku węgla. Dwutlenek węgla sublimuje pod ciśnieniem iw temperaturze pokojowej. Proces odwrotny do sublimacji można nazwać resublimacją lub depozycją. Aby nastąpiła sublimacja, materia musi absorbować energię, dlatego uważa się ją za proces endotermiczny.
Przeczytaj też: Jakie są fizyczne stany materii?
Tematyka tego artykułu
- 1 - Podsumowanie sublimacji
- 2 - Co to jest sublimacja?
-
3 - Działanie sublimacji
- Co to jest prężność pary?
- Prężność pary i sublimacja
- Schemat faz
- 4 - Przykłady sublimacji
- 5 - Rozwiązane ćwiczenia z sublimacji
Podsumowanie o sublimacji
Sublimacja to bezpośrednie przejście z fazy stałej do fazy gazowej, bez przechodzenia przez fazę ciekłą.
Aby zaobserwować sublimację substancji, konieczne są określone warunki ciśnienia i temperatury.
Na sublimację mają wpływ aspekty termodynamiczne, takie jak prężność pary w fazie stałej i interakcje międzycząsteczkowe.
Sublimacja jest procesem endotermicznym.
Przykładem sublimacji jest to, co zachodzi w suchym lodzie, który składa się ze stałego dwutlenku węgla.
Co to jest sublimacja?
sublimacja jest bezpośrednie przejście z fazy stałej do fazy gazowej, bez przechodzenia przez fazę ciekłą. Występuje w określonych warunkach temperatury i ciśnienia dla niektórych ciał stałych. To przejście jest fizycznym procesem zmiany stanu, nie obejmującym reakcji chemicznych.
Proces odwrotny, czyli bezpośrednie przejście z fazy gazowej do fazy stałej, jest różnie nazywany. Niektórzy autorzy zachowują słowo sublimacja dla tej zmiany fazy, podczas gdy inni używają „resublimacji”, a nawet „depozycji”.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Jak działa sublimacja
Można przeprowadzić paralelę między sublimacją a parowaniem. W obu przypadkach punkt końcowy jest faza gazowa. Różnica polega oczywiście na fazie początkowej: ciało stałe do sublimacji i ciecz do odparowania.
W obu przypadkach, występuje wpływ ciśnienia dewaporacji, a także aspekty termodynamiczne, obejmujące ciepło i oddziaływania międzycząsteczkowe.
Co to jest prężność pary?
W zamkniętym pojemniku zawierającym ciecz można zauważyć, że istnieje równowaga między fazą ciekłą a fazą gazową. Dzieje się tak, ponieważ nawet poniżej temperatury wrzenia obecna energia jest wystarczająca, aby niektóre cząsteczki cieczy mogły się odłączyć i przejść do pary. Jednak niektóre cząsteczki pary mogą również ponownie skraplać się i powracać do fazy ciekłej, co świadczy o odwracalności procesu.
Ta para, z której się składa materia (ma masę i objętość), ćwiczenia nacisk na powierzchnię cieczy, znany jako prężność pary. Zależy to nie od ilości cieczy, ale od temperatury, ponieważ im wyższa temperatura, tym łatwiej cząsteczki odrywają się od fazy ciekłej.
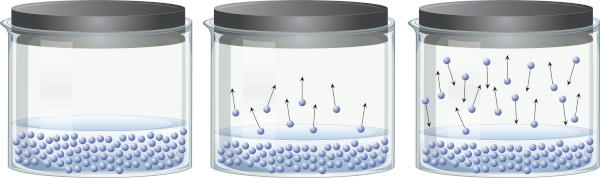
Ciecze, które mają wysoką prężność par w zwykłych temperaturach, nazywane są lotnymi. Na przykład w temperaturze 25°C eter etylowy ma prężność pary 0,58 atm, aceton (propanon) ma prężność pary 0,29 atm, podczas gdy woda ma prężność pary 0,023 atm. Nawiasem mówiąc, gdy prężność pary jest identyczna z ciśnieniem atmosferycznym, ciecz wrze. Aby dowiedzieć się więcej o prężności pary, kliknij Tutaj.
Prężność pary i sublimacja
Chociaż w mniejszym stopniu ciała stałe mają również prężność pary, ale znacznie niższe niż płyny. Na przykład nawet w temperaturze 1000 K prężność pary żelaza wynosi tylko 9,21 x 10-20 bankomat. Jednak niektóre ciała stałe ulegają sublimacji, na przykład jod, wykazując wyższą prężność par w normalnych temperaturach (4 x 10-4 bankomat).
Jest to możliwe tylko przy przejściu cząsteczek ze stanu stałego bezpośrednio do stanu gazowego. Aby tak się stało, o cząsteczki ciała stałego muszą być obecne oddziaływania międzycząsteczkowe słaby (na przykład w jodzie są typu dipol indukowany dipol).
To też widać proces sublimacji jest endotermiczny, czyli istnieje potrzeba, aby cząsteczki ciała stałego absorbowały energię w postaci ciepła, aby mogły przerwać oddziaływania międzycząsteczkowe i przejść do stanu pary. Ilość zaangażowanego ciepła można zmierzyć wielkością termodynamiczną znaną jako entalpia sublimacji.
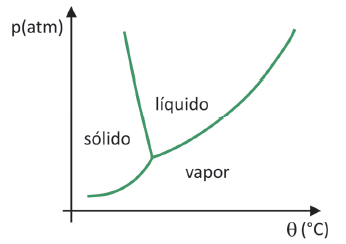
Schemat faz
Do wiedzieć, w jakim zakresie ciśnienia i temperatury zachodzi sublimacja ciała stałego, musisz ocenić swój diagram fazowy. Spójrzmy na przypadek dwutlenku węgla, CO2.

Na diagramie fazowym linie graniczne między stanami (ciało stałe, ciecz i gaz) łączą wartości ciśnienia i temperatury dla następuje zmiana stanu. Obserwując przypadek CO2, można zauważyć, że przy ciśnieniu 1 atmosfery faza stała przechodzi bezpośrednio do fazy gazowej w temperaturze -78,5°C, co charakteryzuje sublimację.
Dwutlenek węgla ma tylko fazę ciekłą przy ciśnieniu powyżej 5,11 atmosfery, a powyżej tego ciśnienia sublimacja nie jest już możliwa. Aby dowiedzieć się więcej o diagramie fazowym, kliknij Tutaj.
przykłady sublimacji
Suchy lód: suchy lód, często używany do tworzenia efektów mgły na imprezach i imprezach, to tak naprawdę dwutlenek węgla w stanie stałym.

kulki na mole: kulki na mole są wykonane z naftalenu, aromatycznego związku organicznego. Stosowany jest do usuwania przykrych zapachów, a także odstraszania moli, karaluchów i innych jadowitych zwierząt, dlatego często stosuje się je w szafkach, a nawet w pisuarach.

Kamfora: Dzięki charakterystycznemu zapachowi kamyczki kamforowe mogą również ulegać sublimacji. Służą również do odstraszania komarów i zapobiegania pleśni.

Jod: niemetal należący do halogenów również ulega sublimacji.

Jednak wśród przedstawionych substancji tylko dwutlenek węgla ulega sublimacji w warunkach otoczenia. Inne, nawet z sublimacją, mogą przejść normalną fuzję pod presją, w której żyjemy.
Przeczytaj też: Plazma — czwarty stan skupienia
Rozwiązane ćwiczenia z sublimacji
Pytanie 1
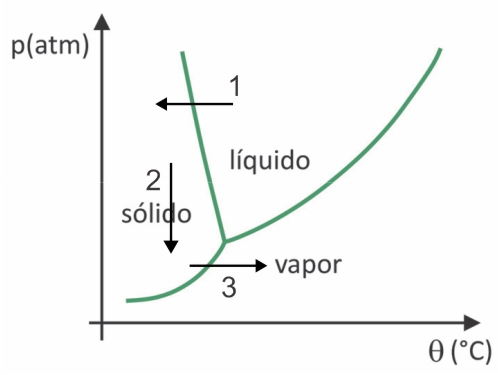
(Fuvest 2020) W supermarketach często można znaleźć tak zwaną żywność liofilizowaną, taką jak owoce, warzywa i mięso. Żywność liofilizowana po długim czasie nadal nadaje się do spożycia, nawet bez chłodzenia. Termin „liofilizowany” w tych produktach odnosi się do procesu zamrażania, a następnie odwadniania przez sublimację wody. Aby nastąpiła sublimacja wody, wymagana jest kombinacja warunków, jak pokazano na wykresie ciśnienie-temperatura, gdzie linie przedstawiają przejścia fazowe.
Pomimo tego, że jest to proces, który wymaga na skalę przemysłową zastosowania określonej technologii, istnieją dowody na to, że ludzie prekolumbijczycy żyjący w najwyższych rejonach Andów potrafili zamrażać suchą żywność, dzięki czemu można ją było przechowywać przez więcej czasu. Sprawdź alternatywę, która wyjaśnia, jak przebiegał naturalny proces liofilizacji:
a) Sublimacja wody nastąpiła w wyniku niskich temperatur i wysokiego ciśnienia atmosferycznego w górach.
b) Żywność, po naturalnym zamrożeniu w zimnych okresach, była przenoszona w najniższe partie gór, gdzie ciśnienie atmosferyczne było niższe, co umożliwiało sublimację.
c) Żywność została wystawiona na działanie słońca w celu podniesienia temperatury, a niskie lokalne ciśnienie atmosferyczne sprzyjało zestaleniu.
d) Temperatury były wystarczająco niskie w zimnych okresach, aby zamrażać żywność, a niskie ciśnienie atmosferyczne w wysokich górach umożliwiało sublimację.
e) Żywność, po naturalnym zamrożeniu, była prasowana w celu zwiększenia ciśnienia, aby mogła zajść sublimacja.
Odpowiedź: Litera D.
W liofilizacji następuje zamrożenie wody z późniejszą sublimacją. Ludy prekolumbijskie mogły przeprowadzić taki proces, ponieważ zimą woda mogła zamarznąć (strzałka 1) a przy niskich ciśnieniach (strzałka 2) najwyższych regionów Andów mogła ulec sublimacji (strzałka 3).
pytanie 2
(Uerj 2005) Suchy lód, czyli zestalony dwutlenek węgla, szeroko stosowany w procesach chłodniczych, w warunkach otoczenia ulega sublimacji. Podczas tej przemiany zachodzą m.in. zjawiska zmienności energii i zakłócenia oddziaływań.
Zjawiska te klasyfikowane są odpowiednio jako:
a) egzotermiczny - międzyjonowy
b) egzotermiczny - międzyjądrowy
c) izotermiczny - międzyatomowy
d) endotermiczny - międzycząsteczkowy
Odpowiedź: Litera D.
Sublimacja jest procesem endotermicznym, ponieważ wymaga absorpcji ciepła w celu przerwania interakcji, które utrzymują zwartość cząsteczek fazy stałej. Oddziaływania te są typu międzycząsteczkowego.
Stefano Araujo Novais
Nauczyciel chemii
Dowiedz się więcej o tym zjawisku.
Odpowiedź leży w zmianach ciśnienia i temperatury.
Dowiedz się o stanach fizycznych materii i zobacz, czym one są. Dowiedz się też, czym jest Bosego-Einsteina i gdzie możemy znaleźć materię w stanie plazmy.
Indukowane siły dipolowe indukowane dipolem to najsłabsze siły międzycząsteczkowe, które występują między cząsteczkami niepolarnymi.
Zobacz, jak określić, czy dana substancja ma wyższą temperaturę wrzenia niż inna, na podstawie zależności między siłami międzycząsteczkowymi a temperaturą wrzenia.



