Naukowiec Friedrich Kohlrausch (1840-1910) jako pierwszy zaproponował, że czysta woda przewodzi elektryczność, choć na małą skalę. Dzieje się tak, ponieważ woda zachowuje się w sposób amfoteryczny; to znaczy, w niektórych przypadkach działa jak kwas, oddając protony (H+); w innych zachowuje się jak baza, przyjmując protony.
Oznacza to, że woda dokonuje własnej jonizacji, zgodnie z przedstawionym poniżej równaniem chemicznym:
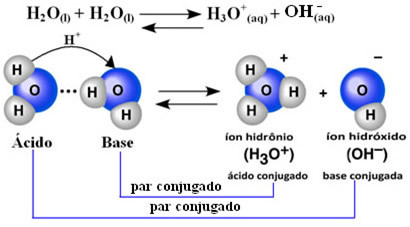
Ten proces nazywa się autojonizacja wody i występuje na bardzo małą skalę, tzn. woda jest bardzo słabym elektrolitem, o niskich wartościach stopnia jonizacji i stałej jonizacji w stanie równowagi (Kdo). Właśnie dlatego woda ma tak niską przewodność.
Aby zorientować się, w temperaturze otoczenia 25°C można wyznaczyć, że stężenia jonów wodorotlenowych i hydroniowych powstających podczas samojonizacji czystej wody są równe 1. 10-7 mol. L-1. Oznacza to, że z miliarda cząsteczek wody tylko dwie jonizują.
Stała równowagi jonowej wody nazywa się dostała dysocjacji wody,stała autoprotolizy
lub jonowy produkt wody.Ta stała jest reprezentowana przez Kw, ponieważ w odnosi się do słowa woda, co w języku angielskim oznacza wodę.Jego obliczenie odbywa się w taki sam sposób, jak innych stałych równowagi, pamiętając o tym, jak stwierdzono w tekście „Stałe Balance Kc and Kp”, w tym przypadku w wyrażeniu pojawią się tylko produkty, ponieważ woda w stanie ciekłym ma taką samą aktywność do 1. Czyste substancje płynne lub stałe nie są uwzględniane w wyrażeniu stałej dysocjacji, ponieważ się nie zmieniają. Umieszczane są tylko roztwory wodne i gazowe. Więc mamy:
Kw = [H3O+]. [O-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Podobnie jak w przypadku innych stałych równowagi, dobrzew zmienia się tylko wraz ze zmianą temperatury. Wraz ze wzrostem temperatury wody wzrasta również jej jonizacja, co oznacza, że samojonizacja wody jest procesem endotermicznym, czyli pochłania ciepło.
Widać to w wartościach iloczynu jonowego wody (Kw) podane w tabeli poniżej w różnych temperaturach:
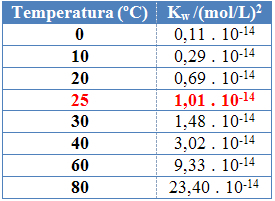
Jonowy produkt wody zawsze będzie miał stałą wartość w każdej temperaturze, czy to w czystej wodzie, czy w roztworze. Nawet jeśli roztwór ma stężenie jonów H3O+ i och- inny, iloczyn między nimi pozostanie stały.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm