TEN hasz, z symbolem Hs i Liczba atomowa 108, jest jednym z pierwiastków znanych jako transaktynowce. Podobnie jak wszystkie elementy tej grupy, nie występuje w naturze, jest syntetyczny, a ponadto jest radioaktywny i niestabilny. Jego syntezę przypisuje się niemieckim laboratoriom Centrum Badań nad Ciężkimi Jonami im. Helmholtza (GSI) w mieście Darmstadium w Niemczech, a jego nazwa została nadana na cześć niemieckiego państwa Hesji, położonego w centralnym regionie rodzice.
Has jest najcięższym pierwiastkiem, którego właściwości są analizowane poprzez eksperymenty przeprowadzane przez sam GSI. Wyniki były ważne dla potwierdzenia pozycji Hs w Układ okresowy pierwiastków, jako podobieństwo między tym pierwiastkiem a osmem i rutenem, lżejsze pierwiastki z grupy 8, dostrzeżono.
Przeczytaj też:Bohrium — syntetyczny pierwiastek chemiczny nazwany na cześć Nielsa Bohr
Podsumowanie haszu
Jest to syntetyczny pierwiastek chemiczny znajdujący się w grupie 8 układu okresowego.
Został zsyntetyzowany przez Gesellschaft für Schwerionenforschung (GSI) w Darmstadium w Niemczech.
To jest pierwiastek radioaktywny i niestabilny.
Dane teoretyczne i eksperymentalne potwierdzają, że jego właściwości przypominają najlżejsze elementy z jego grupy.
Jako transaktynid nie może być wytwarzany na dużą skalę, poza produkcją w tempie kilku atomy.
Właściwości hasu
Symbol: hs
Liczba atomowa: 108
Masa atomowa: 277 j.m.
Elektroniczna Konfiguracja: [Rn] 7s2 5f14 6d6
Najbardziej stabilny izotop: 269Hs (14 drugi okres półtrwania)
Seria chemiczna: grupa 8; transaktynidy; super ciężkie elementy.
Cechy Hass
Hass to pierwiastek syntetyczny i najcięższy z grupy 8. Jest uważany za transaktynid, właśnie dlatego, że pojawia się w układzie okresowym po serii aktynowców. Jak wszystkie transaktyny, has jest pierwiastkiem radioaktywny i niestabilny.
Oznacza to, że jego izotopy osiągają mało czasu pół życia (czas potrzebny do zmniejszenia masy atomu o połowę). Obecnie znanych jest siedem izotopów hasu, których masa waha się od 264 do 270 am. Wśród wszystkich najbardziej stabilny jest izotop 269Hs, z okresem półtrwania 14 sekund.
Chociaż krótki okres półtrwania utrudnia badanie właściwości chemicznych transaktynidów, has miał pod tym względem nieco więcej szczęścia. W czerwcu 2001 ogłoszono, że stał się najcięższy pierwiastek do przeanalizowania jego właściwości.
Zespołowi udało się w mieście Darmstádio w Niemczech wytworzyć około sześciu atomów Hs o okresie półtrwania wynoszącym około 10 sekund. Choć wydaje się to niewiele, to wystarczyło, aby potwierdzić, że tlenek hasu, HsO4, ma silne podobieństwa z tlenkami lżejszych pierwiastków grupy 8, RuO4 i OsO4, to jest ruten to jest osm.
Zobacz też: Seaborgium — kolejny syntetyczny pierwiastek chemiczny o właściwościach radioaktywnych i krótkim okresie półtrwania
Zdobywanie Hassium
Transaktynidy mają wspólną trudność w wytwarzaniu. Na ogół wymagany jest najnowocześniejszy sprzęt, taki jak: akceleratory cząstek. W nich gatunki jonowe zderzają się z elementami o wysokiej masa atomowa do formowania superciężkich pierwiastków (w których zawarty jest Hs).
W przypadku haszu badania potwierdzające jego pozycję w grupie 8 układu okresowego pierwiastków obejmowały jego produkcję poprzez bombardowanie magnezu-26, którego celem był kiur-248.
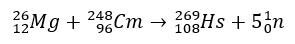
Eksperymenty z tymi pierwiastkami są drogie, dlatego często przeprowadza się badania teoretyczne, aby dokładnie obliczyć i przewidzieć właściwości chemiczne. Krótki okres półtrwania to kolejny czynnik komplikujący.
Techniki eksperymentalne separacja i detekcja musi być bardzo szybki, aby uzyskać wiarygodne wyniki. Wreszcie wydajność reakcji tych pierwiastków jest bardzo niska, mieszcząca się w zakresie kilku jednostek atomowych.
Środki ostrożności z Hassium
Hs nie jest produkowany na dużą skalę, a zatem jego manipulacja nie wiąże się z ryzykiem. Ponadto pozyskiwany jest w ośrodkach badawczych o ściśle kontrolowanych środowiskach.
historia haszu

Transaktynidy były protagonistami sporu naukowego ze względu na: Zimna wojna, a Wojna transferowa, nazwa wymyślona w związku z sporami, które dotyczyły produkcji i rozpoznawania pierwiastków po fermie (Fm, Z = 100). W tym wyścigu laboratoria brały udział:
Wspólny Instytut Badań Jądrowych w Dubnej w Rosji;
Lawrence Berkeley National Laboratory w Berkeley, Kalifornia;
Gesellschaft für Schwerionenforschung (GSI, lepiej tłumaczone jako Centrum Badań nad Ciężkimi Jonami im. Helmholtza) w Darmstadium w Niemczech.
W przypadku elementu 108 zaangażowane były grupy GSI i Dubna. Jednak chociaż naukowcy z Dubnej (kierowani przez Jurija Oganessiana) po raz pierwszy donieśli o obecności pierwiastka 108, przypisali to badaczom z grupy niemieckiej, ponieważ GSI przedstawił bardziej przekonujące wyniki, podczas gdy w jednym eksperymencie udało mu się wyprodukować trzy atomy izotopu 265, podczas gdy w innym wyprodukował jeden atom izotopu 264.
Izotopy te zostały wyprodukowane przy użyciu Universal Linear Accelerator (Unilac, lepiej tłumaczone jako Universal Linear Accelerator), z bombardowaniem 208Pb przez 58Wiara. W 1997 roku Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC) uznała pierwiastek 108 o symbolu Hs za Hassium na cześć niemieckiego państwa Hesji.
Ćwiczenia rozwiązywane na hasz
Pytanie 1
Hass, symbol Hs, jest uważany za najcięższy pierwiastek, którego właściwości zostały przebadane eksperymentalnie. W tym czasie naukowcy byli w stanie określić właściwości tetratlenku hasu, HsO4. W tym gatunku Hs ma taki sam NOx jak lżejsze pierwiastki z jego grupy, osm (Os) i ruten (Ru). Stopień utlenienia Hs w tetratlenku hasu jest równy:
a) 0
B) +2
C) +4
D) +6
E) +8
Rezolucja:
Alternatywne E
TEN tlen, kiedy w a tlenek, otrzymuje ładunek równy -2. Więc NOx Hs, które nazwiemy x, można obliczyć jako:
x + 4(-2) = 0
x-8 = 0
x = +8
pytanie 2
Najbardziej stabilny izotop hasu, Hs, ma okres półtrwania wynoszący zaledwie 14 sekund. To znaczy:
A) w ciągu 14 sekund masa izotopu Hs podwoi się.
B) po 14 sekundach masa izotopu Hs będzie mniejsza niż połowa masy początkowej.
C) w niecałą minutę masa izotopu Hs wyniesie 1/16 jego masy początkowej.
D) w ciągu jednej minuty masa izotopu Hs będzie równa dokładnie połowie jego masy początkowej.
E) za 14 sekund masa izotopu Hs zostanie podzielona przez 4.
Rezolucja:
Alternatywa C
Okres półtrwania wskazuje czas wymagany do zmniejszenia o połowę ilości atomów. Oznacza to, że co 14 sekund ilość Hs spada o połowę. Obserwując ten okres półtrwania, jasne jest, że po 56 sekundach osiągnięto już cztery okresy półtrwania, co powoduje podzielenie masy Hs przez 24, czyli 16.
Stefano Araújo Novais
Nauczyciel chemii

