TEN oganesson, symbol Og, Liczba atomowa 118, jest pierwiastkiem chemicznym o największej jak dotąd liczbie atomowej w układzie okresowym. Nie można go znaleźć w naturze, a jego produkcja jest sztuczna, dlatego uważany jest za pierwiastek syntetyczny. Mimo to jego produkcja jest bardzo trudna i jest uważany za bardzo rzadki pierwiastek, który został zsyntetyzowany bardzo niewiele.
Pomimo bycia w tej samej grupie co Gazy szlachetne, oganesson według obliczeń nie ma wielu cech, które odnoszą się do tych pierwiastków matematycy wykazują, że w konsekwencji efektów relatywistycznych cierpią pierwiastki superciężkie.
Pierwiastek 118 został po raz pierwszy zsyntetyzowany w 2002 roku w reakcji jonów 48Ca z atomami 249Widzieć Jej nazwa to hołd dla rosyjskiego naukowca Jurija Oganessiana, jednego z najbardziej szanowanych i uznanych w dziedzinie superciężkich pierwiastków.
Zobacz też: Rutherfordium — syntetyczny pierwiastek chemiczny nazwany na cześć naukowca Ernesta Rutherforda
Podsumowanie na oganessonie
Oganesson to syntetyczny pierwiastek chemiczny znajdujący się w grupie 18 Układ okresowy pierwiastków.
Po raz pierwszy został zsyntetyzowany w 2002 roku we wspólnej pracy naukowców rosyjskich i amerykańskich.
Stanowi on grupę pierwiastków ostatnio uwzględnionych w układzie okresowym, w 2016 roku.
Jest to pierwiastek bardzo rzadki, syntetyzowany bardzo niewiele razy.
Ich badania są wciąż bardzo nowe, a podstawowe właściwości są nadal określane za pomocą obliczeń i modeli matematycznych.
Wstępne badania teoretyczne wskazują, że pomimo przynależności do grupy gazów szlachetnych, niektóre właściwości dystansują Og od pozostałych pierwiastków.
Produkcja oganessonu następuje przez Fuzja nuklearna, używając jonów 48Ca i atomy 249Widzieć
Jej nazwa to hołd dla rosyjskiego naukowca Jurija Oganessiana, jednego z najważniejszych w dziedzinie badań superciężkich pierwiastków.
Teraz nie przestawaj... Więcej po reklamie ;)
właściwości oganessonu
Symbol: oh
Liczba atomowa: 118.
Masa atomowa: 294 j.m. (nieoficjalne przez Iupac).
Elektroniczna Konfiguracja: [Rn] 7s2 5f14 6d10 7p6.
Najbardziej stabilny izotop: 294Og (0,69 milisekundy okres półtrwania, który można zwiększyć o 0,64 milisekundy lub skrócić o 0,22 milisekundy).
Seria chemiczna: grupa 18, pierwiastki superciężkie, gazy szlachetne.
Charakterystyka oganessonu
Oganesson jest jak dotąd oficjalny element o najwyższej liczbie atomowej (118) przez Międzynarodową Unię Chemii Czystej i Stosowanej (IUPAC). Chociaż został wyprodukowany po raz pierwszy w 2002 roku, niewiele o nim wiadomo. Wiele spekuluje się, ponieważ ten pierwiastek nie występuje w naturze. Jego produkcja odbywa się w laboratorium, które konfiguruje go jako pierwiastek syntetyczny.
Ponadto, Twój pół życia jest krótsza niż milisekunda (10-3 po drugie) — pamiętając, że okres półtrwania to czas potrzebny do zmniejszenia ilości o połowę. Dlatego właściwości, które są określone dla tego pierwiastka, są niczym innym jak wynikami obliczenia teoretyczne oparte na modelach matematycznych, ponieważ w rejonie układu okresowego, w którym się znajduje znajduje efekty relatywistyczne (rozbieżność między oczekiwanymi a obserwowanymi efektami wynikającymi z teorii względności) są znaczące.
Efekty relatywistyczne odciągają Oga od tego, czego od niego oczekiwano. Element, na przykład nie wykazuje podobnego zachowania do gazów szlachetnych. Obliczenia pokazują, że oganesson byłby ciałem stałym w temperaturze pokojowej, o temperaturze topnienia w zakresie 325 ± 15 K (około 52 °C) i temperaturze wrzenia w zakresie 450 ± 10 K (około 177 °C).
Wiadomo również, że Og może być bardziej reaktywny niż inne gazy szlachetne, ponieważ efekty relatywistyczne pozwalają mu łatwiej stracić elektrony z podpoziomu p. Innym punktem niezgody z gazami szlachetnymi jest to, że oganessone jest półprzewodnik, podczas gdy pozostałe są izolatorami.
Przeczytaj też: Wodór — pierwiastek chemiczny o najniższej liczbie atomowej w układzie okresowym
Uzyskanie oganessonu
Podobnie jak inne superciężkie elementy, oganesson uzyskuje się za pomocą techniki zwanej topliwy, gdzie jony izotopu 48Ca, występujący naturalnie, ale bardzo mało dostępny, reaguje ze znacznie cięższymi izotopami, tworząc superciężkie pierwiastki.
Og jest tak rzadkim i trudnym do zdobycia pierwiastkiem, że w ciągu dziesięciu lat tylko cztery atomy przyszedł do produkcji. Zasadniczo produkcja 294Og, jedyny znany izotop, powstaje w wyniku bombardowania jonami 48Ca do rdzenia 249Por. z uwolnieniem 3 neutronów.
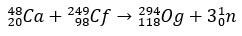
Z kilkoma milisekundami okresu półtrwania, Og został zidentyfikowany poprzez swój wzorzec rozpadu, co jest bardzo powszechne w przypadku superciężkich elementów. W tym przypadku nastąpiły 3 rozpady alfa, powodując, że pierwiastek 118 stał się kopernikiem, Cn, który ostatecznie uległ samoistnemu rozszczepieniu.
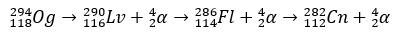
historia oganesson
Pierwsza synteza oganessonu miała miejsce w 2002 roku., w mieście Livermore, Kalifornia, Stany Zjednoczone, w Lawrence Livermore National Laboratory, gdzie grupa amerykańskich naukowców współpracowała z rosyjskimi badaczami słynnego Wspólnego Instytutu Badań Jądrowych (ZIBJ), kierowanego przez rosyjskiego naukowca Jurija Oganessiana.
W okresie dziesięciu lat od pierwszej syntezy zsyntetyzowano tylko cztery atomy oganessonu, ze względu na rzadkość i trudność parametrów reakcji. Jednak czwarty i ostatni atom stanowił niesamowite odkrycie.
Naukowcy próbowali zsyntetyzować pierwiastek 117 poprzez reakcję 48Ca z 249Bk, jednak zauważono, że 28% celu berkelu uległo rozpadowi β, przekształcając się w 249Cf, a tym samym generując element 118. Warto zauważyć, że nazwa elementu 118 honoruje rosyjskiego naukowca Jurija Oganessiana, hołd, który dla żyjących chemików pojawił się tylko dwa razy w historii chemii, pierwszy był dla Glenna Seaborga, z seaborgium.
Rozwiązane ćwiczenia na oganessonie
Pytanie 1
Oganesson, pierwiastek o liczbie atomowej 118 i symbolu Og, znalazł się w siódmym okresie Układu Okresowego, w grupie gazów szlachetnych. W rezultacie wiele spekulowano na temat tego, czy taki pierwiastek będzie charakteryzował się dużą stabilnością, cechą znaną innym pierwiastkom z tej grupy. Przydział Og do grupy 18 wynikał z:
A) ten pierwiastek jest bardzo stabilny.
B) ten pierwiastek ma osiem elektronów w swojej powłoce walencyjnej.
C) pierwiastek ten jest wyraźnie gazem w temperaturze pokojowej.
D) pierwiastek ten ma takie same właściwości chemiczne jak inne gazy szlachetne.
E) ten pierwiastek ma wysoką energię jonizacji.
Rezolucja:
Alternatywa B
Przydział Og odbywa się tylko i wyłącznie ze względu na jego dystrybucja elektroniczna. Fakt, że ma osiem elektronów w warstwa walencyjna, 7s2 7p6, stawia go w tej pozycji. Badania z tym pierwiastkiem są nadal wstępne, ale już spekuluje się, na podstawie wyników matematycznych, że np. Og nie jest gazem w temperaturze pokojowej. Inną kwestią, którą należy podkreślić, jest to, że Og w ogóle nie jest stabilny, nawet nie istnieje w naturze.
pytanie 2
Ogromna trudność w wytworzeniu pierwiastka 118 rodzi przekonanie, że naukowcy byli w prawdziwej odysei, aby móc go wykryć. Nic dziwnego, po dziesięciu latach pierwszej syntezy oganesson zsyntetyzowano tylko trzy razy. I jak dotąd znany jest tylko jeden izotop, 294oh Ile neutronów ma znany izotop oganessonu?
A) 294.
B) 118.
C) 176.
D) 412.
E) 166.
Rezolucja:
Alternatywa C
Liczba neutrony Og można obliczyć w następujący sposób:
A = Z + n
A to liczba makaron atomowy, Z to liczba protonów (lub liczba atomowa), a n to liczba neutronów. Zastępując wartości, mamy:
294 = 118 + n
n = 294 - 118
n = 176
Stefano Araújo Novais
Nauczyciel chemii

