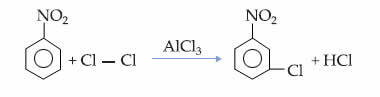
Gęstość to wielkość, którą można obliczyć na podstawie relacji między masą ciała a objętością. Dotyczy to również gazów:
Dgaz = mgaz
Vgaz
Jednostką gęstości gazu jest zwykle g/l.
Wiadomo, że w CNTP (Normalne Warunki Temperatury i Ciśnienia) 1 mol dowolnego gazu zawsze zajmuje objętość 22,4 l. Zatem gęstość gazów w tych warunkach można obliczyć z zależności między masą molową a tą objętością w molach:
Dgaz = ___m_____
22,4 litra. molo-1
Ale ten wzór może być użyty tylko wtedy, gdy gaz znajduje się w CNTP. Jeśli chcemy obliczyć gęstość bezwzględną dla dowolnego gazu, możemy użyć innego wzoru, który znajdujemy za pomocą równania stanu dla gazów:
pV = nRT
Ponieważ n = m/M podstawiamy „n” w równaniu stanu gazu:
pV = mRT
m
m = po południu
V RT
Ponieważ gęstość to masa w stosunku do objętości, to mamy:
d = po południu
RT
To równanie pokazuje nam, że gęstość bezwzględna gazu zależy od ciśnienia i temperatury gdzie jest gaz; nie jest to spowodowane masą, ponieważ nie zależy od ciśnienia i temperatury, ale od objętości.
Zauważ, że gęstość gazu jest odwrotnie proporcjonalna do jego temperatury. To jest zasada, która wyjaśnia, jak działa praktyka balonowania: powietrze w balonie to powietrze atmosferyczne, które po podgrzaniu zmniejsza swoją gęstość i w ten sposób unosi się do nieba. Im bardziej powietrze zawarte w balonie zostanie ogrzane, tym mniejsza będzie jego gęstość i tym wyżej balon się uniesie.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Oto przykład, jak użyć tego wzoru do obliczenia gęstości gazu:
Przykład: Jaka jest bezwzględna gęstość gazowego tlenu (O2) przy 600 mmHg i 127 °C? (Masa atomowa: O = 16)
Rezolucja:
Dane:
Masa molowa: O2: 2. 16 = 32 g/mol;
p=600 mmHg;
R = 62,3 mmHg. L. molo-1. K-1
T = 127 °C → 127 + 273 = 400 K
d = PO POŁUDNIU
RT
d = _600. 32__
62,3. 400
d = 0,774 g/l
Ponieważ w CNTP ciśnienie wynosi 1 atm, temperatura wynosi 273 K, a R jest równe 0,082 lub 22,4/273, mamy:
d = PO POŁUDNIU
RT
d = ___1. m_____
(22,4/273). 273
d = ___m_____
22,4 litra. molo-1
Wracamy do powyższego wzoru dla gazów w CNTP. Spójrzmy na przykład wykorzystania tej formuły:
Przykład: Jaka jest masa cząsteczkowa gazu, którego gęstość bezwzględna w CNTP wynosi 1,96 g/l?
Rezolucja:
d = ___m_____
22,4 litra. molo-1
M = 22,4. D
M = (22,4 l/mol). (1,96 g/l)
M = 43,90 g/mol
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Wyglądać:
FOGAÇA, Jennifer Rocha Vargas. „Gęstość gazów absolutnych”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/densidade-absoluta-dos-gases.htm. Dostęp 27 lipca 2021 r.
Czym są gazy, jakie są właściwości gazów, związków cząsteczkowych, ściśliwości, stałej objętości, energii kinetycznej średnia, temperatura bezwzględna gazu, gaz doskonały, gazy rzeczywiste, gaz doskonały, zmienne stanu gazu, objętość gazu, pory roku