TENdeelprzesłuchanie to procedura laboratoryjna, przemysłowa lub domowa, w której pewna ilość rozpuszczalnik (czysty) jest dodawany lub usuwany (poprzez odparowanie) z wcześniej istniejącego roztworu.
W każdym roztworze zawsze występuje rozpuszczalnik i co najmniej jedna substancja rozpuszczona, jak w mieszaninie 500 ml wody i 10 g chlorek sodu (NaCl) przedstawiony poniżej:
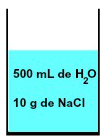
Reprezentacja mieszaniny utworzonej przez wodę i chlorek sodu
Jeśli do tego roztworu zostanie dodana objętość 300 ml wody, procedura ta nazywa się roztwór, gdy objętość roztworu wzrasta – w tym przypadku do 800 ml – jednak bez zmiany ilości substancji rozpuszczonej.

Rozcieńczenie przez dodanie rozpuszczalnika do roztworu soli
TEN roztwór można to również przeprowadzić przez podgrzanie tego roztworu soli (składającego się z 500 ml wody i 10 g NaCl), aż, na przykład, 300 ml wody zostanie odparowany. W takim przypadku objętość roztworu zostałaby zmniejszona, jednak ilość substancji rozpuszczonej nie uległaby zmianie.

Rozcieńczanie przez odparowanie rozpuszczalnika w roztworze soli
Zasady rozcieńczania:
Końcowa objętość roztworu po dodaniu rozpuszczalnika jest zawsze większa niż objętość początkowa;
Końcowa objętość roztworu po usunięciu rozpuszczalnika jest zawsze mniejsza niż objętość początkowa;
Masa substancji rozpuszczonej nigdy nie zmienia się podczas rozcieńczania roztworu;
Liczba molowa substancji rozpuszczonej nigdy się nie zmienia podczas rozcieńczania roztworu;
Gdy rozpuszczalnik jest dodawany do rozcieńczenia, stężenie roztworu końcowego jest zawsze niższe niż stężenie roztworu początkowego;
Gdy rozpuszczalnik jest usuwany w rozcieńczeniu, stężenie roztworu końcowego jest zawsze większe niż stężenie roztworu początkowego.
Formuły stosowane w rozcieńczaniu
⇒ Obliczenie końcowej objętości roztworu:
Objętość końcowego roztworu w rozcieńczeniu, w którym dodaje się rozpuszczalnik, oblicza się według następującego wzoru:
Vfa = Vja + V
Vfa = objętość roztworu końcowego
Vja = objętość roztworu początkowego
V= objętość dodawanego rozpuszczalnika
W przypadku usunięcia rozpuszczalnika z rozcieńczenia końcową objętość oblicza się za pomocą następującego wyrażenia:
Vfa = Vja - Vi
Vi = objętość odparowanego rozpuszczalnika.
⇒ Obliczanie wspólna koncentracja:
Stężenie roztworu końcowego po rozcieńczeniu można obliczyć w następujący sposób:
DOja.Vja = Cfa.Vfa
DOja= wspólne stężenie roztworu początkowego
Vja = objętość roztworu początkowego
DOfa = molarność lub stężenie w mol/L roztworu końcowego
Vfa= objętość roztworu końcowego
⇒ Obliczanie molarność lub stężenie w mol/L:
Molarność roztworu końcowego po rozcieńczeniu można obliczyć za pomocą następującego wyrażenia:
Mja.Vja = Mfa.Vfa
Mja= molarność lub stężenie w mol/L roztworu początkowego
Vja = objętość roztworu początkowego
Mfa = molarność lub stężenie w mol/L roztworu końcowego
Vfa= objętość roztworu końcowego
⇒ Obliczanie tytułu zbiorczego:
Tytuł końcowego rozwiązania, po rozcieńczeniu, można obliczyć za pomocą następującego wyrażenia:
Tja.mja = Tfa.mfa
Tja= tytuł rozwiązania początkowego
mja = masa roztworu początkowego
Tfa = tytuł rozwiązania końcowego
mfa= masa rozwiązania końcowego
Ponieważ tytuł można również obliczyć w procentach, a w roztworach wodnych masa ma zwykle tę samą wartość co objętość, możemy użyć następującego wyrażenia matematycznego:
Pja.Vja =Pfa.Vfa
Pja= procent początkowego rozwiązania
Vja = objętość roztworu początkowego
Pfa = procent końcowego rozwiązania
Vfa= objętość roztworu końcowego
Przykładowe obliczenia wykonane w rozcieńczeniu:
1 przykład - (UFBA) Po dodaniu 300 ml wody do 100 ml 8% roztworu wodorowęglanu sodu uzyskuje się stężenie roztworu:
a) 24% b) 18% c) 9% d) 4% e) 2%
Dane dostarczone przez ćwiczenie:
Procent początkowego rozwiązania (Pja) = 8%
Początkowa objętość roztworu (Vja) = 100 ml
Końcowa objętość roztworu (Vfa) = 400 ml (wynik mieszania od 300 ml do 100 ml)
Procent rozwiązania końcowego (Pfa) = ?
Do obliczenia procentowego stężenia roztworu możemy użyć tych wartości podanych w następującym wyrażeniu:
Pja.Vja =Pfa.Vfa
8100 = Pfa.400
800 = Pfa.400
Pfa = 800
400
Pfa = 2%
Drugi przykład - (UFPA) 200 ml roztworu wodorotlenku magnezu, Mg (OH)2, przygotowano przez rozpuszczenie 2,9 g zasady w wodzie. Jaką objętość tego roztworu należy rozcieńczyć do 300 ml, aby otrzymać roztwór o molowości 0,125 M? Dane: H = 1; Mg = 24; O = 16.
a) 450 ml b) 150 ml c) 400 ml d) 300 ml e) 900 ml
Dane dostarczone przez ćwiczenie:
Masa substancji rozpuszczonej w roztworze początkowym (m1) = 2,9 g
Objętość roztworu do rozcieńczenia = 200 ml lub 0,2 l (po podzieleniu przez 1000)
Początkowa objętość roztworu (Vja), który zostanie rozcieńczony = ?
Końcowa objętość roztworu (Vfa) = 300 ml
Molarność lub stężenie w mol/L roztworu końcowego (Mfa) = 0,125M
Aby obliczyć procentowe stężenie roztworu, musimy wykonać następujące czynności:
Krok 1: Oblicz masę molową substancji rozpuszczonej.
W tym celu musimy pomnożyć liczbę atomów każdego pierwiastka przez odpowiednią masę atomową, a następnie dodać wyniki:
MMg(OH)2 = 1.24 + 2.16 + 2.1
MMg(OH)2 = 24 + 32 + 2
MMg(OH)2 = 58 g/mol
Krok 2: Oblicz stężenie w mol/L lub molarności roztworu początkowego:
Mja = m1
MV
Mja = 2,9
58.0,2
Mja = 2,9
11,6
Mja = 0,25 mol/L
Krok 3: Określ objętość roztworu, który zostanie rozcieńczony, korzystając z wartości podanych i zawartych w następującym wyrażeniu:
Mja.Vja = Mfa.Vfa
0,25.Vja = 0,125.300
0,25.Vja = 37,5
Vja = 37,5
0,25
Vja = 150 ml
Trzeci przykład - (UEG-GO) Weź pod uwagę, że 100 mL wodnego roztworu siarczanu miedzi o stężeniu równym 40 g. L–1dodano 400 ml wody destylowanej. W takim przypadku każdy ml nowego roztworu będzie miał masę w mg równą:
a) 2 b) 4 c) 8 d) 10
Dane dostarczone przez ćwiczenie:
Objętość wody dodanej do rozcieńczenia = 400 ml
Początkowa objętość roztworu (Vja) = 100 ml
Końcowa objętość roztworu (Vfa) = 500 ml (wynik mieszania od 400 ml do 100 ml)
Powszechne stężenie roztworu początkowego (Cja) = 40g. L–1
Wspólne stężenie roztworu końcowego (Cfa) w mg/ml=?
Aby obliczyć stężenie roztworu w mg/mL, musimy wykonać następujące czynności:
Krok 1: Przelicz wyjściowe stężenie roztworu z g/L na mg/mL.
Aby to zrobić, musimy pomnożyć zarówno licznik, jak i mianownik przez 1000 i po prostu podzielić dane stężenie przez 1000:
DOja = 40g 1000
1L. 1000
DOja = 40 mg/ml
Dlatego jednostki g/l i mg/ml są takie same.
Krok 2: Oblicz stężenie w mg/ml, korzystając z wartości podanych w następującym wyrażeniu:
DOja.Vja = Cfa.Vfa
40100 = Cfa.500
4000 = Cfa.500
DOfa = 4000
500
DOfa = 8 mg/ml
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diluicao.htm