Związki organiczne można przedstawić na wiele sposobów, takich jak płaski wzór strukturalny, uproszczony lub skondensowany wzór strukturalny lub wzór z myślnikiem. Jednak najprostszą reprezentacją jest wzór cząsteczkowy.

Zobaczmy zatem, jak wyznaczyć wzór cząsteczkowy związków organicznych na podstawie innych wymienionych powyżej wzorów.
1. Poprzez Płaski Wzór Strukturalny:ten wzór pokazuje rozmieszczenie lub rozmieszczenie atomów w cząsteczce. Na przykład poniżej znajduje się płaski wzór strukturalny jednego z węglowodorów obecnych w benzynie.

Zauważ, że w tym wzorze pokazane są wszystkie atomy i wszystkie istniejące wiązania między nimi. Ale już, aby określić wzór cząsteczkowy tego związku, wystarczy policzyć liczbę atomów każdego pierwiastka i umieścić indeks w prawym dolnym rogu danego pierwiastka.
Ważnym aspektem, który należy podkreślić, jest to, że wzór cząsteczkowy związków organicznych zawsze zaczynamy od pierwiastka węgiel, ponieważ jest głównym składnikiem tych substancji. Zobacz przykład:
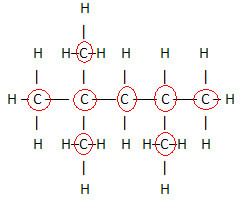
Ponieważ węgli jest 8, zaczynamy pisać wzór cząsteczkowy w ten sposób: C8
Aby uzupełnić ten wzór, liczymy ilość wodorów:
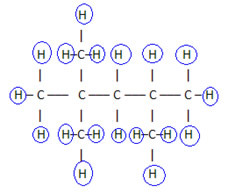
dlatego twój formuła molekularna é C8h18.
2. Poprzez uproszczony lub skondensowany wzór strukturalny: w tego typu formule ilość wodorów jest skrócona. Na przykład spójrz na ten sam wzór cząsteczki znajdującej się w benzynie, teraz w postaci skondensowanej:
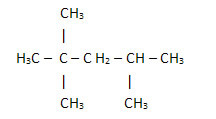
W ten sposób jeszcze łatwiej policzyć ilość wodorów, wystarczy dodać wskaźniki (3 +3+ 3 +2 +1 +3 +3 = 18).
Ale teraz spójrzmy na skondensowany wzór strukturalny kwasu linolowego, który występuje w warzywach takich jak bawełna, soja, słonecznik itp. i który jest używany w farbach i lakierach:
h3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
Licząc ilość węgli, wodorów i tlenów, mamy co następuje formuła molekularna kwasu linolowego: C18h32O2.
3. Poprzez formułę udaru: ten wzór dodatkowo upraszcza sposób przedstawiania związków organicznych, ponieważ pomija grupy C, CH, CH2 i CH3.
Przykładem jest cząsteczka linolowa, zobaczcie jak wygląda:

Najpierw policzmy ilość węgli, pamiętając, że w tym wzorze każde wiązanie między węglem jest reprezentowane przez myślnik. Tak więc końcówki, podobnie jak dwa punkty przegięcia, odpowiadają atomom węgla.
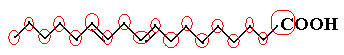
Więc mamy: C18
Teraz, aby policzyć ilość wodorów, musimy pamiętać, że wiązania między węglem a wodorami są implikowane, ponieważ wiadomo, że węgiel tworzy cztery wiązania; tak więc ilość wiązań, których brakuje, jest ilością wodoru związanego z tym pierwiastkiem.
Zobacz wyjaśnienia poniżej:
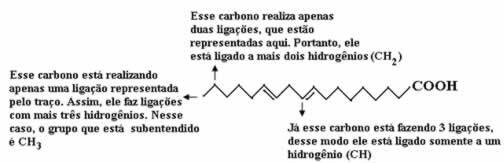
Zatem ilość wodorów wyniesie: 32.

Ilość tlenu jest dość łatwa do policzenia, ponieważ są tylko dwa. Ponieważ formuła molekularna é: C18h32O2.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm


