Nie wszystkie cząsteczki substancji są proste, jakby znajdowały się na jednej płaszczyźnie. W końcu są one rozproszone w przestrzeni, a ich atomy przybierają różne układy lub układy. Tak więc cząsteczki każdego rodzaju substancji mają różne kształty geometryczne.
Jeden z najprostszych sposobów określenia geometrii cząsteczki opiera się na teorii odpychanie par elektronów powłoki walencyjnej (RPECV). Zgodnie z tą teorią pary elektronów centralnego atomu funkcjonują jako elektroniczne chmury które się odpychają. W ten sposób są zorientowane jak najdalej od siebie. Geometria molekularna będzie zależeć od liczby par elektronowych wokół centralnego atomu.
Ta chmura elektronowa może składać się z elektronów, które uczestniczą w wiązaniach (pojedynczych, podwójnych lub potrójnych), a także które nie uczestniczą. Więc mamy:
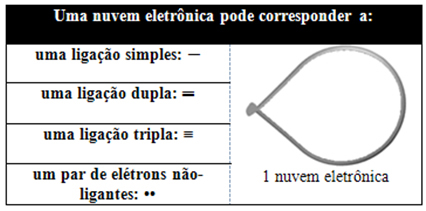
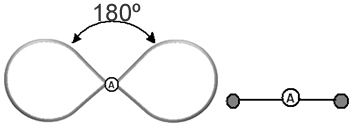
Pomaga myśleć o tej chmurze jako o balonie lub balonach na uwięzi, z centralnym atomem w ich centrum. Na przykład w cząsteczce, która ma tylko dwa obłoki elektronów wokół centralnego atomu, większy możliwa odległość między nimi to kąt 180º, a co za tym idzie, geometria cząsteczki będzie liniowy.
Dlatego możemy wywnioskować, jaka będzie geometria molekularna większości cząsteczek, jeśli weźmiemy pod uwagę liczba atomów w cząsteczkach i wiązania, które tworzy centralny atom, sprawdzając, czy ma pary elektrony.
Zobacz przykłady poniżej:
- Cząsteczki z 2 atomami: zawsze będzie liniowy
Na przykład:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
- Cząsteczka 3-atomowa: kątowe lub trójkątne
jeśli centralny atom posiadają parę niewiążących elektronów geometria będzie kątowy, jak w przypadku cząsteczki SO2:
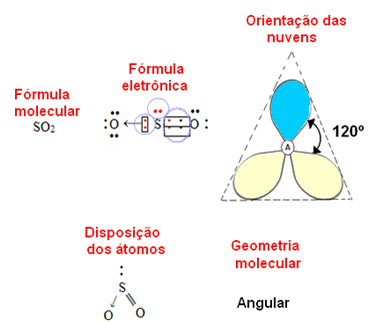
Rozważ niebieską chmurę elektronową, która reprezentuje pary elektronów, które nie uczestniczą w wiązaniach, a żółtą, jako pary elektronów, które uczestniczą w wiązaniach.
- Cząsteczka 4-atomowa: płaszczyzna trygonalna (lub trójkątna) lub piramidalna (lub piramida trygonalna)
Jeśli centralny atom nie ma niesparowanej (niewiążącej) pary elektronów, geometria molekularna jest płaska, trygonalna (lub trójkątna). Spójrz na przykład BF3:

Jeśli atom ma niewiążące pary elektronów, geometria cząsteczki będzie piramidalna (lub trygonalna), jak w przypadku amoniaku:

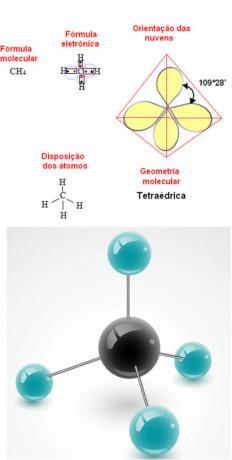
- Cząsteczka 5-atomowa: czworościenny
Przykład geometrii metanu:
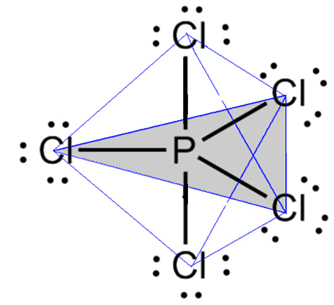
- Cząsteczka z 6 atomami: trójkątna bipiramida lub trójkątna piramida.
Przykładem jest pentachlorek fosforu (PCl5), który ma pewne połączenia między fosforem i chlorem pod kątem 90º, a inne 120º, tworząc bipiramidę o trójkątnej podstawie:
- Cząsteczka 7-atomowa: ośmiościenny
Przykład: sześciofluorek siarki (SF6), których kąty wynoszą 90º.

Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm
