Związki z tej grupy nie występują w przyrodzie jako wolne, dlatego konieczne jest uzyskanie metod, które zostały opracowane w laboratorium. Poniżej zostaną zidentyfikowane i wyjaśnione trzy główne metody przygotowania alkoholi:
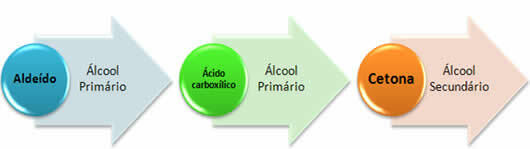
1.) Redukcja aldehydów, ketonów i kwasów karboksylowych: Redukcja jest reakcją przeciw utlenianiu, w której stosuje się gazowy wodór (H2) lub wodór pochodzący z Zn i HCl lub z Zn i kwasu octowego.
Przykłady:
*Aldehyd:
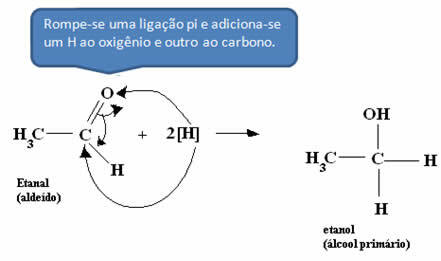
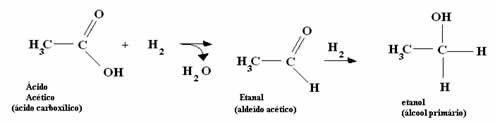
*Kwas octowy: Kwas jest najpierw przekształcany w aldehyd, a następnie przeprowadzany jest proces wymieniony w poprzednim punkcie.
*Keton: Ponieważ ta grupa funkcyjna z definicji znajduje się pomiędzy dwoma atomami węgla, jej redukcja utworzy drugorzędowe alkohole.
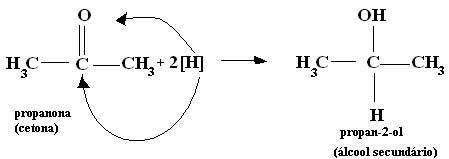
W skrócie mamy:
2) Hydratacja alkenów: Innym sposobem wytwarzania alkoholi jest reakcja między alkenem a wodą w środowisku kwaśnym, jak pokazano w poniższym przykładzie:
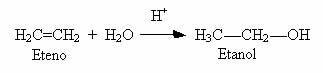
Dopiero kiedy zaczniesz od etylenu, otrzymasz pierwszorzędowy alkohol, wszystkie inne są drugorzędne.
3) Synteza Grignarda: Związki Grignarda są związkami typu:
RMgX lub ArMgX gdzie: R=alkil
ar= arila
X= halogen
Związki te są bardzo reaktywne, dzięki jonizacji:
RgX → R- + MgX+
Jon R- nazywa się karboanion i robi atak nukleofilowy do innej cząsteczki organicznej, która ma karbonatyzacja, czyli węgiel dodatni. Tak więc w kontakcie z aldehydami, ketonami i estrami powstają pierwszorzędowe, drugorzędowe i trzeciorzędowe alkohole:
Przykłady:
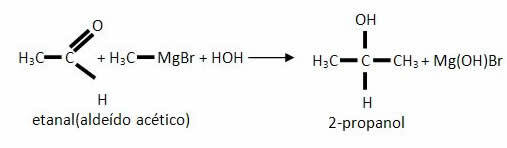
*Aldehydy:
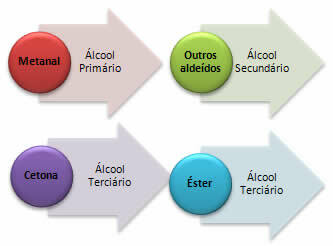
a) Metal – produkuje alkohol pierwszorzędowy:

b) Wszystkie inne aldehydy, inne niż metanol, będą wytwarzać alkohol drugorzędowy:
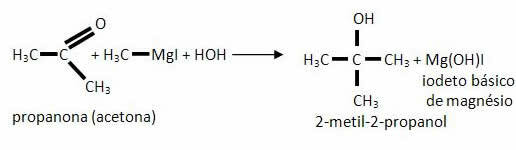
*Keton: Otrzymany zostanie alkohol trzeciorzędowy.
*Ester: Karbonyl estrów reaguje ze związkami Grignarda tworząc keton, ale nie pozostaje w tym związku, ponieważ jest reaktywność jest większa niż w przypadku początkowych estrów, więc reakcja przebiega dalej, jak pokazano w ostatnim punkcie, w celu utworzenia alkoholu trzeciorzędowy.
Jennifer Fogaça
Absolwent chemii
Brazylijska drużyna szkolna
| Alkohole to związki organiczne, które mają grupę hydroksylową lub oksyrylową (OH) przyłączoną do nasyconego atomu węgla. |
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/metodos-preparacao-dos-alcoois.htm